توقع بنية البروتين
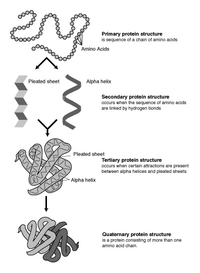
توقع بنية البروتين هو إحدى الطرق المعلوماتية الحيوية والكيمياء النظرية لاستخراج نموذج لشكل البنية البروتينية في شكلها الثلاثي الأبعاد للبروتينات انطلاقا من المعلومات عن تسلسل الحموض الأمينية ضمن البروتين. بشكل آخر، يمكن أن نقول أنه التوقع بالبنية الثالثية اعتبارا من البنية الأولية. مثل هذا الموضوع وتشكيل نماذج للبنية الثالثية للبروتين له تطبيقات عملية كثيرة مثل تصميم الدواء المنطقي rational drug design الذي يعد أحد أكثر الحقول نشاطا بحثيا في الوقت لاراهن كل عامين يتم تقييم فعالية الطرق الحالية من خلال تجربة التقدير التوقعي لبنية البروتين (CASP)؛ ويبدي برنامج ألفافولد نتائج ممتازة في هذا المضمار.[1]
بنية البروتين والمصطلحات
[عدل]البروتينات هي سلاسل من الأحماض الأمينية انضمت معا من قبل روابط الببتيد. العديد من التوافقات من هذه السلسلة ممكنة بسبب دوران السلسلة حول كل ذرة Cα. ومن هذه التغييرات التوافقية التي هي المسؤولة عن الاختلافات في بنية ثلاثي الأبعاد للبروتينات. كل حمض أميني في السلسلة هو قطبي، أي أنه قد فصل المناطق الإيجابية والسلبية المشحونة مع C = O المجموعة الحرة، والتي يمكن أن تكون بمثابة متقبل السندات الهيدروجين ومجموعة نه، والتي يمكن أن تكون بمثابة المتبرع السندات الهيدروجين. وبالتالي يمكن لهذه المجموعات أن تتفاعل في بنية البروتين. ويمكن تصنيف 20 الأحماض الأمينية وفقا للكيمياء من السلسلة الجانبية التي تلعب أيضا دورا هيكليا هاما. الجليكاين يأخذ على موقف خاص، كما أن لديها أصغر سلسلة جانبية، ذرة الهيدروجين واحد فقط، وبالتالي يمكن أن تزيد من المرونة المحلية في بنية البروتين. السيستين من ناحية أخرى يمكن أن تتفاعل مع بقايا السيستين آخر، وبالتالي تشكيل وصلة الصليب استقرار البنية كله.
ويمكن اعتبار بنية البروتين بمثابة تسلسل من عناصر الهيكل الثانوي، مثل هلايس α و β ورقة، والتي تشكل معا التكوين ثلاثي الأبعاد الشاملة لسلسلة البروتين. في هذه الهياكل الثانوية يتم تشكيل أنماط منتظمة من H السندات بين الأحماض الأمينية المجاورة، والأحماض الأمينية لها زاوي Φ و similar مماثلة.
تشكيل هذه الهياكل تحييد المجموعات القطبية على كل حمض أميني. الهياكل الثانوية معبأة بإحكام في جوهر البروتين في بيئة مسعور. تحتوي كل مجموعة جانبية من الأحماض الأمينية على حجم محدود للاحتلال وعدد محدود من التفاعلات المحتملة مع سلاسل جانبية مجاورة أخرى، وهي حالة يجب أخذها في الاعتبار في النمذجة الجزيئية والمحاذاة
انظر أيضا
[عدل]مراجع
[عدل]- ^ Jumper, John; Evans, Richard; Pritzel, Alexander; Green, Tim; Figurnov, Michael; Ronneberger, Olaf; Tunyasuvunakool, Kathryn; Bates, Russ; Žídek, Augustin; Potapenko, Anna; Bridgland, Alex (Aug 2021). "Highly accurate protein structure prediction with AlphaFold". Nature (بالإنجليزية). 596 (7873): 583–589. Bibcode:2021Natur.596..583J. DOI:10.1038/s41586-021-03819-2. ISSN:1476-4687. PMC:8371605. PMID:34265844.
