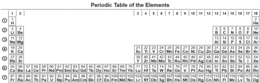
الجدول الدوري
| صنف فرعي من | |
|---|---|
| جزء من | |
| البداية | |
| الاسم المختصر | |
| سُمِّي باسم | |
| اشتق من | |
| بلد المنشأ | |
| يُصوِّر | |
| المكتشف أو المخترع |
ديميتري مندلييف (1869) |
| مكان الصنع | |
| له جزء أو أجزاء |
| جزء من سلسلة حول |
| الجدول الدوري للعناصر الكيميائية |
|---|
 |
| بوابة العناصر الكيميائية |

الجدول الدوري ترتيب مجدول للعناصر الكيميائية، مرتبة حسب عددها الذري، والتوزيع الإلكتروني، والخواص الكيميائية المتكررة، والذي يُظهر هيكله اتجاهات دورية. بشكل عام، تكون العناصر في الصف واحد (الدورة) فلزات باتجاه اليسار، ولا فلزات باتجاه اليمين، بحيث توضع العناصر التي لها سلوكيات كيميائية مماثلة في نفس العمود. تسمى صفوف الجدول عادةً بالدورات وتسمى الأعمدة بالمجموعات. وتمتلك ستة مجموعات أسماء بالإضافة إلى الأرقام المخصصة: على سبيل المثال، عناصر المجموعة 17 هي الهالوجينات؛ والمجموعة 18 هي الغازات النبيلة. كما أنه يُعرض في شكل أربع مناطق مستطيلة بسيطة أو مستويات فرعية مرتبطة بملء المدارات الذرية المختلفة.
يمكن استخدام تنظيم الجدول الدوري لاشتقاق العلاقات بين خواص العناصر المختلفة، وأيضًا الخصائص والسلوكيات الكيميائية المتوقعة للعناصر غير المكتشفة أو المركَّبة حديثًا. كان الكيميائي الروسي ديمتري مندلييف أول من نشر جدولًا دوريًا معروفًا في عام 1869، وقد تم تطويره بشكل أساسي لتوضيح الاتجاهات الدورية للعناصر المعروفة آنذاك. كما توقع بعض خصائص العناصر غير المحددة التي كان من المتوقع أن تملأ الفجوات داخل الجدول. ثبتت صحة معظم توقعاته. وقد تم توسيع فكرة مندلييف ببطء وصقلها مع اكتشاف أو توليف عناصر جديدة أخرى وتطوير نماذج نظرية جديدة لشرح السلوك الكيميائي. يوفر الجدول الدوري الحديث الآن إطارًا مفيدًا لتحليل التفاعلات الكيميائية، ولا يزال يستخدم على نطاق واسع في الكيمياء، والفيزياء النووية، والعلوم الأخرى.
تم اكتشاف أو تركيب جميع العناصر من العدد الذري 1 (هيدروجين) إلى 118 (أوغانيسون)، واستكمال الصفوف السبعة الأولى من الجدول الدوري.[1][2] توجد العناصر الـ 98 الأولى في الطبيعة، على الرغم من أن بعضها موجود فقط بكميات شحيحة وأن البعض الآخر تم تصنيعه في المختبرات قبل أن يتم العثور عليه في الطبيعة.[n 1] تم تركيب العناصر 99 إلى 118 فقط في المختبرات أو المفاعلات النووية.[3] ويجري حاليًا متابعة تجميع العناصر التي تحتوي على أعداد ذرية أعلى: تبدأ هذه العناصر في الصف الثامن، وقد اقترح العمل النظري مرشحين محتملين لهذا التمديد. كما أُنتجت العديد من النويدات المشعة الاصطناعية من العناصر الطبيعية في المختبرات.
بنية الجدول الدوري
[عدل]| المجموعة → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| الدورة ↓ | ||||||||||||||||||
| 1 | title="H , هيدروجين" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 1 H |
title="He, هيليوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 2 He | ||||||||||||||||
| 2 | title="Li, ليثيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 3 Li |
title="Be, بيريليوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 4 Be |
title="B , بورون" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 5 B |
title="C , كربون" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 6 C |
title="N , نيتروجين" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 7 N |
title="O , أكسجين" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 8 O |
title="F , فلور" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 9 F |
title="Ne, نيون" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 10 Ne | ||||||||||
| 3 | title="Na, صوديوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 11 Na |
title="Mg, مغنسيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 12 Mg |
title="Al, ألومنيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 13 Al |
title="Si, سيليكون" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 14 Si |
title="P , فوسفور" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 15 P |
title="S , كبريت" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 16 S |
title="Cl, كلور" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 17 Cl |
title="Ar, أرغون (عنصر)" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 18 Ar | ||||||||||
| 4 | title="K , بوتاسيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 19 K |
title="Ca, كالسيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 20 Ca |
title="Sc, سكانديوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 21 Sc |
title="Ti, تيتانيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 22 Ti |
title="V , فاناديوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 23 V |
title="Cr, كروم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 24 Cr |
title="Mn, منغنيز" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 25 Mn |
title="Fe, حديد" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 26 Fe |
title="Co, كوبالت" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 27 Co |
title="Ni, نيكل" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 28 Ni |
title="Cu, نحاس" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 29 Cu |
title="Zn, زنك" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 30 Zn |
title="Ga, غاليوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 31 Ga |
title="Ge, جرمانيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 32 Ge |
title="As, زرنيخ" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 33 As |
title="Se, سيلينيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 34 Se |
title="Br, بروم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 35 Br |
title="Kr, كريبتون" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 36 Kr |
| 5 | title="Rb, روبيديوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 37 Rb |
title="Sr, سترونتيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 38 Sr |
title="Y , إتريوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 39 Y |
title="Zr, زركونيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 40 Zr |
title="Nb, نيوبيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 41 Nb |
title="Mo, موليبدنوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 42 Mo |
title="Tc, تكنيشيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 43 Tc |
title="Ru, روثينيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 44 Ru |
title="Rh, روديوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 45 Rh |
title="Pd, بلاديوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 46 Pd |
title="Ag, فضة" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 47 Ag |
title="Cd, كادميوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 48 Cd |
title="In, إنديوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 49 In |
title="Sn, قصدير" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 50 Sn |
title="Sb, إثمد" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 51 Sb |
title="Te, تيلوريوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 52 Te |
title="I , يود" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 53 I |
title="Xe, زينون" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 54 Xe |
| 6 | title="Cs, سيزيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 55 Cs |
title="Ba, باريوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 56 Ba |
title=" , لانثانيدات" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| | title="Hf, هافنيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 72 Hf |
title="Ta, تانتالوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 73 Ta |
title="W , تنغستن" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 74 W |
title="Re, رينيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 75 Re |
title="Os, أوزميوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 76 Os |
title="Ir, إريديوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 77 Ir |
title="Pt, بلاتين" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 78 Pt |
title="Au, ذهب" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 79 Au |
title="Hg, زئبق" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 80 Hg |
title="Tl, ثاليوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 81 Tl |
title="Pb, رصاص" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 82 Pb |
title="Bi, بزموت" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 83 Bi |
title="Po, بولونيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 84 Po |
title="At, أستاتين" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 85 At |
title="Rn, رادون" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 86 Rn |
| 7 | title="Fr, فرانسيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 87 Fr |
title="Ra, راديوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 88 Ra |
title=" , أكتينيدات " style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| | title="Rf, رذرفورديوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 104 Rf |
title="Db, دبنيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 105 Db |
title="Sg, سيبورجيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 106 Sg |
title="Bh, بوريوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 107 Bh |
title="Hs, هاسيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 108 Hs |
title="Mt, مايتنريوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 109 Mt |
title="Ds, دارمشتاتيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 110 Ds |
title="Rg, رونتجينيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 111 Rg |
title="Cn, كوبرنيسيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 112 Cn |
title="Nh, نيهونيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 113 Nh |
title="Fl, فليروفيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 114 Fl |
title="Mc, موسكوفيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 115 Mc |
title="Lv, ليفرموريوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 116 Lv |
title="Ts, تينيسين" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 117 Ts |
title="Og, أوغانيسون" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 118 Og |
| لانثينيدات * | title="La, لانثانوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 57 La |
title="Ce, سيريوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 58 Ce |
title="Pr, براسيوديميوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 59 Pr |
title="Nd, نيوديميوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 60 Nd |
title="Pm, بروميثيوم " style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 61 Pm |
title="Sm, ساماريوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 62 Sm |
title="Eu, يوروبيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 63 Eu |
title="Gd, غادولينيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 64 Gd |
title="Tb, تيربيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 65 Tb |
title="Dy, ديسبروسيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 66 Dy |
title="Ho, هولميوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 67 Ho |
title="Er, إربيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 68 Er |
title="Tm, ثوليوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 69 Tm |
title="Yb, إتيربيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 70 Yb |
title="Lu, لوتيتيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 71 Lu |
|||
| أكتينيدات ** | title="Ac, أكتينيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 89 Ac |
title="Th, ثوريوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 90 Th |
title="Pa, بروتكتينيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 91 Pa |
title="U , يورانيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 92 U |
title="Np, نبتونيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 93 Np |
title="Pu, بلوتونيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 94 Pu |
title="Am, أمريكيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 95 Am |
title="Cm, كوريوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 96 Cm |
title="Bk, بركليوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 97 Bk |
title="Cf, كاليفورنيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 98 Cf |
title="Es, أينشتاينيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 99 Es |
title="Fm, فرميوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 100 Fm |
title="Md, مندليفيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 101 Md |
title="No, نوبليوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 102 No |
title="Lr, لورنسيوم" style="text-align:center; color:transparent; background-color:transparent; border:transparent; ;"| 103 Lr |
|||
هذا الترتيب الشائع للجدول الدوري يفصل اللانثانيدات (lanthanoids) والأكتينيدات (actinoids) (عناصر المستوى الفرعي f) من العناصر الأخرى. والجدول الدوري العريض يضم عناصر المستوى الفرعي-f. الجدول الدوري الممتد يضيف الدورة الثامنة والتاسعة، ودمج عناصر المستوى الفرعي-f وإضافة عناصر المستوى الفرعي-g النظرية.
فئات العناصر في الجدول الدوري
| |||||||||||||||||||||||
|
| ||||||||||||||||||||||
يحتوي كل عنصر كيميائي على عدد ذري فريد (Z) يمثل عدد البروتونات في نواتها.[n 2] تحتوي معظم العناصر على أعداد مختلفة من النيوترونات مع اختلاف الذرات، ويشار إلى هذه الذرات المختلفة بأنها نظائر. على سبيل المثال، يحتوي الكربون على ثلاثة نظائر موجودة بشكل طبيعي: تحتوي جميع ذراتها على ستة بروتونات، ومعظمها يحتوي على ستة نيوترونات أيضًا، ولكن حوالي واحد بالمائة منها يحتوي على سبعة نيوترونات، ويحتوي جزء صغير جدًا على ثمانية نيوترونات. لا يتم فصل النظائر أبدًا في الجدول الدوري. يتم تجميعها دائمًا معًا تحت عنصر واحد. تمتلك العناصر التي لا تحتوي على نظائر مستقرة كتل ذرية لنظائرها الأكثر استقرارًا، حيث تظهر هذه الكتل، مدرجة بين قوسين.[4]
في الجدول الدوري القياسي، يتم سرد العناصر بترتيب زيادة العدد الذري Z (عدد البروتونات في نواة الذرة). يبدأ الصف الجديد (الدورة) عندما يحصل غلاف التكافؤ الجديد على أول إلكترون له. يتم تحديد الأعمدة (المجموعات) حسب التوزيع الإلكتروني للذرة؛ العناصر التي لها نفس عدد الإلكترونات في مستوى فرعي معين تقع في نفس الأعمدة (على سبيل المثال الأكسجين والسيلينيوم في نفس العمود لأن كلاهما يحتويان على أربعة إلكترونات في الجزء الخارجي من المستوى الفرعي p). وتندرج العناصر التي لها خصائص كيميائية مماثلة في نفس المجموعة في الجدول الدوري عمومًا، على الرغم من أن العناصر الموجودة في الدورة نفسها، في المستوى الفرعي f، تحظى أيضًا بخصائص متشابهة. وبالتالي، من السهل نسبيًا التنبؤ بالخصائص الكيميائية لعنصر ما إذا عرف المرء خصائص العناصر المحيطة به.[5]
اعتبارًا من عام 2016، يحتوي الجدول الدوري على 118 عنصر مؤكد، من العنصر 1 (الهيدروجين) إلى 118 (أوغانيسون). أكد الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) العناصر الأحدث اكتشافًا 113، و115، و117، و118، رسميًا في ديسمبر 2015. وأعلن الاتحاد الدولي للكيمياء البحتة والتطبيقية أسماءهم المقترحة، نيهونيوم (Nh)، موسكوفيوم (Mc)، تينيسين (Ts)، أوغانيسون (Og) على التوالي، في يونيو 2016 وأصبحت رسمية في نوفمبر 2016.[6][7][8][9]
توجد العناصر الـ 94 الأولى بشكلٍ طبيعي. وتوجد العناصر الـ 24 المتبقية، والعناصر من الأمريسيوم حتى الأوغانيسون (95-118)، فقط عند توليفها في المختبرات. يوجد 83 عنصرًا ابتدائيًا من العناصر الـ 94 المتواجدة طبيعيًا، و 11 تحدث فقط في سلاسل اضمحلال للعناصر البدائية.[3] لم يلاحظ أي عنصر أثقل من أينشتاينيوم (العنصر 99) على الإطلاق في الكميات العيانية في شكله النقي، ولا عنصر الأستاتين (العنصر 85)؛ وصُوِر عنصر الفرانسيوم (العنصر 87) فقط في صورة ضوء ينبعث من الكميات المجهرية (300,000 ذرة).[10]
التصنيف
[عدل]المجموعات
[عدل]المجموعة هي العمود الرأسي في الجدول الدوري للعناصر. يوجد في الجدول 18 مجموعة في الجدول الدوري القياسي. العناصر الموجودة في كل مجموعة لها نفس تركيب غلاف التكافؤ من حيث عدد الإلكترونات، وهذا يعطي لهذه العناصر تشابها في الخواص. كما أن الجدول يمتاز بدقة ترتيب العناصر الكيميائية، فكلما تم الانتقال من سطر لآخر، فإنه يزيد عدد الطبقات، وكلم تم الانتقال من عمود لآخر يزيد عدد الإلكترونات في الطبقة الخارجية.
أرقام المجموعات
[عدل]هناك ثلاثة أنظمة لترقيم المجموعات: الأول باستخدام الأرقام العربية، والثاني باستخدام الأرقام الرومانية، والثالث مزج بين الأرقام الرومانية والحروف اللاتينية. وقد تم اختيار الترقيم العربي من قبل الاتحاد الدولي للكيمياء والكيمياء التطبيقية. وقد تم تطوير هذا النظام المقترح من IUPAC ليحل محل الأرقام الرومانية حيث أنها قد تسبب الالتباس نظرا لأنها تستخدم نفس الأسماء لمعان مختلفة.

توضيح تركيب الجدول الدوري
[عدل]كل غلاف من أغلفة الطاقة في ذرات العناصر ينقسم إلى مستويات فرعية عديدة، والتي تمتلئ بزيادة الرقم الذري للعناصر طبقا للترتيب التالي:
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d 6f
7s 7p 7d 7f
ويتم توزيع الإلكترونات بناءً على المستويات الفرعية بالترتيب التالي:
ويمكننا بهذا الترتيب أن نوزع الإلكترونات في أي عنصر من عناصر الجدول الدوري ويجب علينا أن نتذكر دائماً عند الترتيب عدد الإلكترونات في كل مستوى فرعي من هذه المستويات
s=2
p=6
d=10
f=14
وهذا الترتيب الإلكتروني لـ(أوغانيسون) العنصر الأخير في الجدول الدوري:
Uuo118= 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
....
هذا الترتيب يماثل ترتيب الجدول الدوري. ونظرا لأن الإلكترونات في مستويات الطاقة الخارجية هي التي تحدد خواص العناصر الكيميائية، فإن العناصر تميل لأن تكون متشابهة في مجموعات الجدول الدوري. العناصر التي تلى بعضها في مجموعة الجدول الدوري يكون لها خواص فيزيائية متشابهة بالرغم من الاختلاف الكبير بين كتلة كل منها. بينما العناصر التي تلى بعضها في دورة الجدول الدوري يكون لها كتلة متشابهة ولكن تختلف في خواصها الفيزيائية.
فمثلا، يوجد بقرب النيتروجين (N) عنصر الكربون (C) والأكسجين (O) (عند النظر للدورة). وبغض النظر عن تقاربهم في الكتلة (مقدرا الاختلاف بينهم مجرد وحدات كتل ذرية محدودة)، فإن لهم خواص مختلفة تماما، والذي يمكن ملاحظته عند النظر إلى خاصية التآصل: فمثلا عندما يكون الأكسجين ثنائي الذرة فهو غاز ويساعد على الاحتراق، بينما النيتروجين ثنائي الذرة يكون غاز لا يساعد على الاشتعال، والكربون صلب يمكن أن يحترق (يمكن للألماس أن يحترق.
وبالعكس، فإنه بالقرب من الكلور (Cl) عند النظر للمجموعة، في المجموعات الأخيرة كل من الفلور (F) والبروم (Br). وبغض النظر أيضا عن اختلافها الكبير في الكتلة فإن لها خواص متقاربة للغاية. فهي جميعا عناصر تساعد على التآكل بشدة (أي أنها ترتبط بسرعة مع الفلزات لتكون أملاح هاليدات الفلز)، الكلور والفلور غازات، ولكن البروم سائل له درجة غليان منخفضة للغاية، كما أن الكلور والبروم لهما لون.
تاريخ الجدول الدوري
[عدل]كان أرسطو عام 330 ق.م يعتبر العناصر أربعة هي الأرض والهواء والنار والماء. وفي عام 1770 صنف لافوازييه 33 عنصر. وفرق بين الفلزات (المعادن) واللافلزات. وفي عام 1828 صنع جدولا للعناصر وأوزانها الذرية ووضع للعناصر رموزها الكيميائية. وفي عام 1829 وضع دوبرينر ثلاثة جداول بها ثلاثة مجموعات كل مجموعة تضم 3 عناصر متشابهة الخواص. المجموعة الأولى تضم الليثيوم والصوديوم والبوتاسيوم والثانية تضم الكالسيوم والإسترونشيوم والباريوم. والثالثة تضم الكلورين والبرومين واليود. وفي عام 1864 رتب جون نيولاندز (John Newlands) 60 عنصرا حسب الأوزان الذرية ووجد تشابها ما بين العنصر الأول والعنصر التاسع والعنصر الثاني والعنصر العاشر إلى آخره من الترتيب. فاقترح قانون اوكتاف the 'Law of Octaves'.وكان ديمتري مندليف Dmitri Mendeleev - عالم كيميائي روسي ولد بمدينة توبوليسك بسيبيريا عام 1834 - عرف بأنه أبو الجدول الدوري للعناصر the periodic table of the elements. وهذا الجدول له أهميته لدراسة الكيمياء وفهم وتبسيط التفاعلات الكيميائية حتى المعقدة منها. ولم يكن مندليف قد رتب الجدول الدوري للعناصر فقط، بل كتب مجلدين بعنوان مبادئ الكيمياء Principles of Chemistry. مات في 20 يناير 1907.
تم اقتراح الجدول الدوري الأصلي بدون معرفة التركيب الداخلي للذرات، فلو تم ترتيب العناصر طبقا للكتلة الذرية، ثم تم وضع الخواص الأخرى فيمكن ملاحظة التكرارية التي تحدث للخواص عند تمثيلها مقابل الكتلة الذرية. أول من أدرك تلك التكرارية هو الكيميائي الألماني جوهان فولفجانج دوبرينير والذي لاحظ عام 1829 وجود ثلاثيات من العناصر تتقارب في صفاتها.
| بعض الثلاثيات | ||
|---|---|---|
| العنصر | الكتلة الذرية | الكثافة |
| كلور | 35.5 | 0.00156 g/cm3 |
| بروم | 79.9 | 0.00312 g/cm3 |
| يود | 126.9 | 0.00495 g/cm3 |
| كالسيوم | 40.1 | 1.55 g/cm3 |
| سترانشيوم | 87.6 | 2.6 g/cm3 |
| باريوم | 137 | 3.5 g/cm3 |
وبعد ذلك لاحظ الكيميائي الإنجليزي جون أليكساندر ريينا نيولاندز عام 1865، أن العناصر ذات الخواص المتشابهة تتكرر بدورية مقدارها 8 عناصر، مثل ثمانيات السلم الموسيقي، وقد لاقى هذا الاقتراح ثمانيات نيولاند سخرية من معاصريه. وأخيرا في عام 1869 ، قام الألماني يوليوس لوثر ماير والكيميائي الروسي ديمتري إيفانوفيتش ميندليف تقريبا في نفس الوقت بتطوير أول جدول دوري، بترتيب العناصر طبقا للكتلة. وقد قام مندليف بتغيير وضع مكان بعض العناصر نظرا لأن مكانها الجديد يتماشى بصورة أفضل مع العناصر الجديدة المجاورة لها، وقد تم تصحيح بعض الأخطاء في وضع بعض العناصر طبقا لقيم الكتل الذرية، وتوقع أماكن وجود بعض العناصر التي لم تكتشف بعد. وقد تم إثبات صحة جدول مندليف لاحقا بعد اكتشاف التركيب الإلكتروني في القرن 19، القرن 20.
في عام 1940 قام جلين تى سيبورج بتوضيح بعد-يورانيوم اللانثينيدات والأكتينيدات والتي يمكن أن توضع ضمن الجدول أو أسفله (كما موضح بالأعلى)
جدول مندليف
[عدل]
كان ديمتري مندليف حاول تصنيف العناصر من خلال ملاحظاته ان بعض العناصر لها خاصية كيميائية وفيزيائية متشابهة. وهذا التشابه اعتبره مندليف المفتاح للكشف عن النماذج الخفية في العناصر. فبدأ بكتابة بطاقات عليها العناصر والحقائق الثابتة والمعروفة عنها. وجعل لكل عنصر بطاقة دون عليها درجة الانصهار والكثافة واللون والوزن الذري لذرة كل عنصر والقوة الترابطية له. وعدد الروابط التي يستطيع العنصر تكوينها. ولما فرغ مندليف من تدوين البطاقات حاول تصنيفها بعدة طرق. وأخيرا لاحظ أن ثمة نماذج بدت له من خلال ترتيب هذه العناصر حسب الزيادة في الكتلة الذرية atomic mass أو الوزن الذري. فلاحظ أن القوة الترابطية the bonding power للعناصر من الليثيوم lithium حتى الفلورين fluorine تغيرت بطريقة مرتبة. فمثلا بعد الفلورين fluorine نجد العنصر الأثقل الصوديوم الذي له نفس القوة الترابطية كالليثيوم. لهذا رتب مندليف بطاقة الصوديوم تحت بطاقة الليثيوم. وهذا معناه في جدول مندليف أن العنصر له نفس الخاصية كالعنصر الذي فوقه أو العنصر الذي تحته. ورغم هذا لم يكن جدول مندليف كاملا أو دقيقا. لأن ترتيب العناصر به حسب تزايد الكتلة(الوزن) الذرية atomic mass لكل عنصر، خلف 3 فراغات بجدوله وقال مندليف أن هذه الفراغات ستملآ بعناصر لم تكتشف بعد. ومن خلال موقعها في جدوله استطاع أن يبين خواصها. ونشر جدول مندليف عام 1869م. ومعنى كلمة دوري "periodic" أن أنماطا من خواص العناصر متكررة في كل صف. وبعد 16 سنة من نشر جدول مندليف استطاع الكيميائيون اكتشاف العناصر الثلاثة المفقودة من الجدول وهي اسكانيديوم scandium وجاليوم gallium وجرمانيوم germanium. وكانت خواصها تشبه ما ذكره مندليف عنها. فالجدول الدوري نجده جدولا للعناصر الكيماوية مرتبة لتبين خواصها الكيمائية والفيزيائية. غير أن عناصر كالكلورين والحديد والنحاس مواد كيماوية أساسية لا تتكسر بالتفاعلات الكيماوية. عكس المركبات الكيماوية التي تتكون من عدة عناصر. فالجدول الدوري وسيلة لترتيب العناصر المعروفة حتى العناصر التي لم تكتشف بعد. حقيقة العناصر المتشابهة في الخواص توضع في نفس المجموعة بالجدول الدوري.
اقرأ أيضا
[عدل]ملاحظات
[عدل]- ^ The elements discovered initially by synthesis and later in nature are technetium (Z=43), promethium (61), astatine (85), neptunium (93), plutonium (94), americium (95), curium (96), berkelium (97) and californium (98).
- ^ An نيوترونيوم (i.e. a substance composed purely of neutrons), is included in a few alternate presentations, for example, in the Chemical Galaxy.
المراجع
[عدل]- ^ "Chemistry: Four elements added to periodic table". BBC News. 4 يناير 2016. مؤرشف من الأصل في 4 يناير 2016.
- ^ St. Fleur، Nicholas (1 ديسمبر 2016). "Four New Names Officially Added to the Periodic Table of Elements". New York Times. مؤرشف من الأصل في 14 أغسطس 2017.
- ^ ا ب Emsley، J. (2011). Nature's Building Blocks: An A-Z Guide to the Elements (ط. New). New York, NY: Oxford University Press. ISBN:978-0-19-960563-7. مؤرشف من الأصل في 2022-08-10.
- ^ Greenwood & Earnshaw, pp. 24–27
- ^ Gray, p. 6
- ^ CNN، Ashley Strickland. "New elements on the periodic table are named". CNN. مؤرشف من الأصل في 10 يونيو 2016. اطلع عليه بتاريخ 11 يونيو 2016.
{{استشهاد ويب}}:|الأخير=باسم عام (مساعدة) - ^ "Discovery and assignment of elements with atomic numbers 113, 115, 117 and 118". الاتحاد الدولي للكيمياء البحتة والتطبيقية. 30 ديسمبر 2015. مؤرشف من الأصل في 13 يونيو 2016.
- ^ "Hello, Nihonium. Scientists Name 4 New Elements On The Periodic Table". NPR.org. مؤرشف من الأصل في 10 يونيو 2016. اطلع عليه بتاريخ 11 يونيو 2016.
- ^ Koppenol، W. H. (2002). "Naming of New Elements (IUPAC Recommendations 2002)" (PDF). Pure and Applied Chemistry. ج. 74 ع. 5: 787–791. DOI:10.1351/pac200274050787. ISSN:0033-4545. مؤرشف (PDF) من الأصل في 31 أكتوبر 2008.
- ^ Silva، Robert J. (2006). "Fermium, Mendelevium, Nobelium and Lawrencium". في Morss، L. R.؛ Edelstein، N. M.؛ Fuger، J. (المحررون). The Chemistry of the Actinide and Transactinide Elements (ط. 3rd). Dordrecht, The Netherlands: سبرنجر. ISBN:1-4020-3555-1.
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||