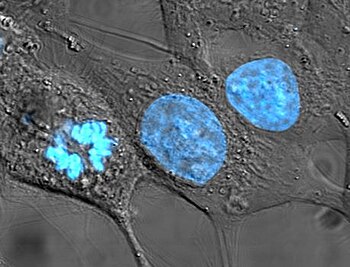
نواة (خلية)
| صنف فرعي من | |
|---|---|
| جزء من | |
| يدرسه | |
| يتفاعل مادياً مع |
| علم الأحياء الخلوي | |
|---|---|
| الخلية الحيوانية | |
 مكونات الخلية الحيوانية النموذجية:
| |
النَّواة (الجمع: نَوَيات ونَوًى) في الخلية عُضَّيةٌ بغشاء مغلق تتواجد في حقيقيات النوى. حقيقيات النوى عادةً تملك نواة واحدة، لكن أنواع قليلة من الخلايا مثل كريات الدم الحمراء عند الثدييات تكون عديمة النوى، بينما تملك أنواعٌ أخرى العديد من النوى.
تحتوي النواة على معظم المادة الوراثية الموجودة في الخلية، منتظمة على شكل جزيئات خطية طويلة من الحمض النووي الريبوزي منقوص الأوكسجين DNA على شكل معقد بالإضافة إلى مجموعة كبيرة من البروتينات، مثل الهستونات، لتُشَكِّل الكروموسومات أو الصبغيات. الجينات أو المورثات المحمولة على هذه الكروموسومات أو الصبغيات، تُشَكِّل معاً المجموع الوراثي أو الجينوم، وتأخذ هذه الجينات هذه البنية لتعزيز وظيفة الخلية. تحافظ النواة على وجود الجينات معاً وتحافظ على سلامتها، وتتحكم كذلك في أنشطة الخلية من خلال تنظيم التعبير الجيني، وبالتالي فإن النواة تُعتَبَرُ مركز التحكم في الخلية. الهياكل الرئيسية التي تُشَكِّلُ النواة هي الغلاف النووي، وهو غشاء مزدوج يُغلِّف النواة ويعزل محتوياتها عن الهيولى الخلوية أو السيتوبلازما الخلوية، وكذلك المصفوفة النووية (التي تتضمن الصفيحة النووية) وهي شبكة من الألياف التي تمنح النواة دعماً ميكانيكياً، كالهيكل الخلوي الذي يدعم الخلية ككل.
بما أن الغشاء النووي غير نفوذ للجزيئات الكبيرة، هناك حاجةٌ لوجود مسامات نووية لتنظيم النقل النووي للجزيئات عبر الغلاف النووي. تجتاز المسام النووية طبقتَي الغشاء النووي وتوفّر قناةً يمكن للجزيئات الصغيرة والأيونات العبور من خلالها بحرية، بينما تحتاج الجزيئات الأكبر إلى بروتينات حاملة لنقلها بشكل فاعل. بعض الجزيئات الكبيرة مثل البروتينات والحمض النووي الريبوزي RNA تجتاز المسامات كشرط لتتمكن من التعبير الجيني والحفاظ على الكروموسومات. على الرغم من أن المنطقة الداخلية من النواة لا تحتوي على حجرات داخلية مزودة بغشاء، إلا أنّ محتوياتها غير متجانسة. حيث تتواجد بعض الأجسام المصنوعة من بروتينات معينة، وجزيئات من الحمض النووي الريبوزي RNA، وأجزاء معينة من الكروموسومات. أشهر هذه الأجسام هو النُوَيَّة، التي تشارك بشكل رئيسي في تجميع الكروموسومات، وكذلك إن الريبوسومات تُصنّع في النويّة ومن ثم تنطلق إلى السيتوبلازما، حيث تقوم بترجمة الحمض النووي الريبوزي الرسول mRNA.
التاريخ
[عدل]

تُعتبر النواة أول عضية تم اكتشافها، كما تظهر أقدم الرسوم المحفوظة للمجهريّ أنطوني فان ليفينهوك (1632-1723)، حيث لاحظ تجويفاً داخل نواة خلايا الدم الحمراء للسلمون.[2] على عكس خلايا الدم الحمراء في الثدييات، حيث يعتبر السلمون من الفقاريات التي لا تزال خلايا الدم الحمراء عندها تحتوي على نواة.
وصف فرانزباور أيضاً النواة عام 1804.[3] وبتفصيل إضافي من قبل عالم النبات الإسكتلندي روبرت براون عام 1831، حيث لاحظ أثناء دراسته نبات الأوركيد تحت المجهر منطقة معتمة في خلايا الطبقة الخارجية للزهرة، دعاها بالهالة أو النواة.[4] لم يقترح حينها أي وظيفة للنواة.
في عام 1838، اقترح ماتياس شلايدن للنواة دوراً في توليد الخلايا، وبناءً على هذا اقترح اسم أرومة الخلية Cytoblast أي بانية الخلية. قال ماتياس أنه قد لاحظ خلايا جديدة متجمعة حول «أرومة الخلية» كما سمّاها. كان فرانز ماين خصماً قويَّاً لهذه الفكرة، حيث كان قد قال أن زيادة أعداد الخلايا تتم بالانقسام، كما أنه اعتقد أن العديد من الخلايا لا تحوي نواة. فيما بعد تم نقض فكرة تولُّد الخلية من جديد من خلال «أرومة الخلية» أوغيرها بعملٍ لروبربت لامارك (1852)، ورودولف فيرشو (1855) والذي تحدث بشكل حاسم عن أن التكاثر يتم عبر توليد خلايا جديدة من خلايا قديمة. وظلت وظيفة النواة غير واضحة.[5]
بين عامي 1877 و1878 نشر أوسكار هريتفيغ دراسات عديدة عن تخصيب بيوض قنفذ البحر، حيث تبين أن نواة الحيوان المنوي تدخل البويضة وتتكامل مع نواتها. كانت تلك المرة الأولى التي يتم الحديث فيها عن تطور الفرد بدءاً من نواة خلية مفردة. كانت هذه النظرة تناقض نظرية إرنست هيغل التي كانت تتحدث عن أن التاريخ العرقي بأكمله يُعاد أثناء التطور الجنيني، بما في ذلك تكون أول خلية منوَّاة بدءاً من كتلة بدائية مخاطية عديمة البنية، لذا فقد نُوقِشت أهمية دور نواة النطفة في عملية التخصيب لمدة طويلة. على أيّة حال فإن هيرتفيغ أكّد مشاهدته في مجموعات حيوانات أخرى، بما في ذلك البرمائيات والرخويات. خرج إدوارد ستراسبرجر بنتائج مماثلة في النباتات عام 1884. مهّد هذا الطريق لتحديد دور النواة في الوراثة. في 1873 افترض أغسطس وايزمان تكافؤ الخلايا الجنسية الأبوية والأمومية في الوراثة، وأصبحت فيما بعد وظيفة النواة كحامل للمعلومات الجينية واضحة، لاسيّما بعد اكتشاف الانقسام الخيطي أو التفتلي وإعادة اكتشاف القوانين الماندلية في بداية القرن العشرين، حيث تطورت أيضاً بناءاً على ذلك نظرية الكروموسوم (الصبغيات).[5]
التراكيب
[عدل]النواة أكبرُ العُضَيَّات في الخلية الحيوانية.[6] في خلايا الثدييات يكون متوسط قطر النواة 6 ميكرومتر، وهذا يشغل قرابة 10% من حجم الخلية[7]، تتضمن النواة أيضاً سائلاً لزجاً يدعى البلازما النووية nucleoplasm (أو Karyolymph) وهي مشابهة للعصارة الخلوية في التركيب.[8] تظهر النواة كعضيّة كثيفة خشنة ذات شكل كروي أو شاذ. تتركب النواة الجافة تقريباً من:
- 9% DNA
- 1% RNA
- 11% هستونات (وهي إحدى أنواع البروتينات)
- 65% بروتينات حامضية
- 14% بروتينات متبقية
الغشاء النووي والمسامات
[عدل]الغلاف النوَوِيّ، كذلك يُدعى الغشاء النوَوِيّ وهو طبقة مزدوجة من الغشاء الخُلَوِيّ، داخليّة وخارجيّة، متوازيتان وتفصل بينهما 10-50 نانومتر. يُغلّف الغلاف النووي النواة بالكامل ويفصل المادة الوراثيّة للخلية عن السيتوبلازما المحيطة بالنواة، فيقوم الغلاف النووي مقامَ حاجزٍ يمنع انتشار الجزيئات بحرية بين البلازما الخلويّة والبلازما النوويّة.[9] يستمر الغشاء النووي الخارجي مع غشاء الشبكة السيتوبلازمية الداخلية الخشنة (الشبكة الإندوبلاسمية الخشنة RER) ويبدو مُرَصَّعاً بالريبوسومات.[9] كما تستمر المسافة بين الغشائين النُوَوِيَّين مع أجواف الشبكة السيتوبلاسمية الداخلية الخشنة RER.
المسام النووية، التي توفر قنوات مائية خلال الغلاف النوي، وتتكون هذه المسامات النووية من بروتينات متعددة، يُشار إليها مجتمعةً بالنوكليوبورينات. يَزِن المسام النووي أو الثقب النووي 125 دالتون، وتتألف من حوالي 50 (كما في الخميرة) حتى مئات البروتينات (كما في الفقاريات).[6] يبلغ القطر الكُلِّي للمسام النووي 100 نانومتر، أما الفجوة التي تنتشر من خلالها الجزيئات بحرية فيبلغ قطرها 90 نانومتر، وذلك لوجود أجهزة تنظيمية داخل المسام. يسمح هذا الحجم بمرور الجزيئات الصغيرة الذوّابة بالماء، في حين لا يُسمح للجزيئات الكبيرة، مثل الحموض الأمينية والبروتينات الأكبر بالمرور عبر المسام النووي بشكل خارج عن إرادة النواة. بينما يتم نقل هذه الجزيئات بشكل فاعل عند الحاجة. عند الثدييّات، تمتلك نواة الخلية النموذجية حوالي 3000-4000 مسام في جميع أنحاء الغلاف[10]، كلٌ من هذه المسامات يحتوي على هيكل بشكل حلقة مكونة من ستة عشر ضلعاً مُتَوضِعةٌ بشكل يسمح بالتحام الغشائين النوويّين الداخلي والخارجي.[11] يرتبط بهذه الحلقة بنية تُدعى بالسلة النووية، تمتد في البلازما النووية، بالإضافة إلى سلسلة من الملحقات الخيطية التي تصل إلى السيتوبلازما. تتواسط هاتان البنيتان الارباطب بروتينات النقل النووية.[6]
تنتقل معظم البروتينات، ووحدات الريبوسومات الفرعية وبعض الحموض النووية الريبوزية منقوصة الأوكسجين DNAs عبر مُعَقّدات المسامات عبر عملية تتواسطها عوامل نقل تُدعى بالكاريوفرينات Karyophreins. تدعى الكاريوفرينات التي تتواسط دخول جزيئات إلى النواة بـimproteins، بينما تلك التي تتواسط خروج جزيئات من النواة بـexproteins. تتفاعل معظم الكاريوفرينات مع الحمولة بشكل مباشر، على الرغم من أن بعضها يستخدم بروتينات مُهيِّئة.[12] أما الهرمونات الستيروئيدية كالكورتزول والألدوستيرون، فضلاً عن غيرها من الجزيئات الدهنية الصغيرة الذوّابة التي تشارك بنقل الإشارات بين الخلايا، يمكن لهذه الجزيئات أن تنتشر عبر غشاء الخلية إلى السيتوبلاسما، وهناك ترتبط ببروتينات المستقبلات النووية، لتنتقل إلى داخل النواة، حيث تعمل هناك كعوامل نسخ عند وجود الربيطة.[6]
الصفيحة النووية
[عدل]توفّر شبكتان من الخيوط الدقيقة الدعمَ الميكانيكيّ للنواة في الخلايا الحيوانية ، حيث تشكّل الصفيحة النووية شبكة منظمة على الوجه الداخلي للغلاف النووي، وشبكة غير منظمة على الوجه المقابل للعصارة الخلوية من الغلاف النووي. كلا الشبكتان توفران دعمًا هيكليًا للغلاف النووي وتُؤمِّن ترسيخ مواقع الكروموسومات والمسام النووية.[7]
تتكوّن الصفيحة النووية في معظمها من بروتينات لامين. ككل البروتينات تتصنع بروتينات لامين في السيتوبلاسما وتُنقل لاحقاً إلى داخل النواة، حيث تتجمع قبل أن تُدمج في شبكة الصفيحة النووية.[13][14] ترتبط اللامينات (بروتينات لامين) الموجودة على الوجه العصاري الخلوي للنواة من الغلاف النووي ترتبط بالهيكل الخلوي لتقدم دعماً هيكلياً. تم العثور على لامينات داخل جِبلة النواة حيث أنها تشكل هيكلاً منتظماً آخر والمعروفة باسم الحجاب البلازمي النووي.[15] وهذا يبدو مرئياً باستخدام المجهر الفلوري.
وظيفة الحجاب الفعلية غير واضحة، على الرغم من إخراجه من النويّة ويتواجد الحجاب أثناء الطور البيني.[16] بُنى اللامينات التي تُشكّل الحجاب تربط الكروماتين وتمَزُق بنيتها يُعَطِّل نسخ جينات البروتينات.[17]
مثل مكونات الخيوط المتوسطة، تكون وحيدات اللامينات مكوّنة من مجال حلزوني ألفا يُستخدم من وحيدتان تلتفان حول بعضهما، مكونتين بنية مزدوجة تُدعى اللولب الملتف. تنضم فيما بعد اثنتان من هذه البنى المزدوجة في ترتيب متوازي وبجهتين متعاكستين لِتُشَكِّلا خيطاً بدئياً. ثمانية من هذه الخيوط البدئية تلتوي لتشكل خيطاً شبه حبليّ. يمكن لهذه الخيوط أن تتجمع أوتتفكك بطريقة ديناميكية، وهذا يعني أن التغيرات في طول الخيط يعتمد على درجة المنافسة على إضافة الخيوط أو إزالتها.[7]
الطفرات في جينات اللامينات تؤدي إلى عيوب في تجميع الخيوط مسبّبة مجموعة اضطرابات وراثية نادرة معروفة باسم اعتلال اللامينات. وأبرز اعتلالات اللامينات هي عائلة من الأمراض تُدعى بالشيا، وهي تسبّب ظهور شيخوخة مبكرة لدى المصابين بالمرض. ما تزال الآلية الدقيقة للتغيرات الكيميائية الحيوية التي تعطي هذا النمط الظاهري (الشيخوخة المبكرة) غير مفهومة بشكل دقيق.[18]
الكروموسومات
[عدل]
تحتوي نواة الخلية على معظم المادة الوراثية في الخلية على شكل عدّة جزيئات DNA خطية منتظمة في بُنى تُدعى الكروموسومات أو الصبغيّات. تحتوي كل خلية بشرية على حوالي مترين من الحمض النووي DNA. خلال معظم الدورة الخلوية تنتظم هذه الجزيئات ضمن معقد بروتيني من الحمض النووي DNA يُدعى بالكروماتين، وأثناء انقسام الخلية يُمكن رؤية الكروماتين بشكل واضح المعالم على هيئة كروموسومات. نسبة صغيرة من الجينات الخلوية تقع في الميتاكوندريا.
هنا كنمطان من الكروماتين. الكروماتين الحقيقي وهو شكل لِـDNA أقل اندماجاً، ويحتوي على جينات، تقوم الخلية بالتعبير عنها.[19] النمط الآخر هو الكروماتين المغاير هوشكلٌ أكثر إحكاماً من الحمض النووي الذي يتم نسخه بشكل غير منتظم أو متكرر. وكذلك يتم تصنيف الكروماتين المغاير إلى كروماتين مغاير اختياري يتألف من الجينات التي يتم تنظيمها ككروماتين مغاير في أنواع خلوية محددة، أو مراحل محددة من التطور، وكروماتين مغاير تأسيسي يتكوّن من مكونات الكروموسومات الهيكلية كالقطعة النهائية (التيلومير) والقسيم المركزي (السنترومير).[20] وخلال الطور البيني ينظم الكروماتين نفسه في رقع فردية منفصلة[21]، تدعى أقاليم الكروموسوم[22]، وتميل الجينات النشيطة الموجودة عموماً في الكروماتين الحقيقي إلى التوضّع على المناطق الحدودية من الكروموسوم.[23]
ترتبط بعض الأجسام المضادة لأجزاء من منظومة الكروماتين، وعلى وجه الخصوص الجسيم النووي، لتؤدي إلى أمراضٍ مناعيّة ذاتيّة، كمرض الذئبة الحمامية الجهازية.[24] تُعرفُ هذه الأجسام المضادة باسم العوامل المضادة للنواة، لُوحِظت هذه العوامل في التصلب المتعدد كجزء من اختلال وظيفة جهاز المناعة بشكل عام.[25] أمّا في حالة الشياخ فإن الدور الذي تلعبه الأجسام المضادة في إحداث الأعراض المتعلقة بالمناعة الذاتية غير واضحٍ حتّى الآن.
النُويّة
[عدل]

النُويّة بُنية ملوّنة كثيفة ومنفصلة موجودة داخل النواة، غير محاطة بغشاء، وتُدعى أحياناً بالعضيّة الفرعيّة. تشكّل النوية حولها تكرارات مترادفة من rDNA، وهو الحمض النووي الريبوزي منقوص الأوكسجين الريبوسومي، وهو الـDNA المرمّز لتصنيع rRNA، الحمض النووي الريبوزي الريبوسومي الضروري لتخليق البروتين في الخلية. تُدعى هذه المناطق مناطق التنظيم في النوية. يُعتبر تصنيع rRNA وتجميع الريبوسومات الدورَ الرئيسي الذي تلعبه النوية. يعتمد التماسك الهيكلي للنُويّة على نشاطها، بالإضافة إلى تجميع الريبوسومات. تم التأكد من هذا النموذج في الحفاظ على الهيكل عبر تثبيط rDNA، والذي أدّى إلى اختلاط هيكل النويّة.[26]
يبدأ تجميع الريبوسومات عبر بروتين يدعى رنا بوليميراز 1 يقوم بنسخ دنا الريبوسومي rDNA، ويتشكل طلائع rRNA كبيرة. ثم تنقسم الطلائع إلى وحدات فرعية من rRNA.[27] تتم عمليات النسخ والمعالجة بعد النسخ وتجميع rRNA داخل النُويّة، بمساعدة جزيئات RNA صغيرة من النوية بعضها مشتقّ من إنترونات من الجينات المُشفِّرة لرنا مرسال mRNA المرتبطة بوظيفة الريبوسومات. تعتبر الوحدات الفرعية للريبوسومات المجتمعة أكبر البنى التي تعبر المسامات النووية.[6]
يُمكن ملاحظة تمايز النويّة إلى ثلاث مناطق تحت المجهر الإلكتروني: في العمق نجد المراكز اللييفية، مُحاطةً بالمركب اللييفي الكثيف، والذي يُحدّد بالمكوّن الحبيبي. يحدث نسخ rDNA في المراكز اللييفية أو المناطق الحدودية بين المراكز اللييفية والمركّب الليفي الكثيف، لذا تتكاثف هذه المنطقة عند نسخ rDNA، أما عمليات الانقسام وتعديل rRNA تحدث في المركب اللييفي الكثيف، بينما تحدث الخطوات اللاحقة في المركّب الحبيبي وهي تتضمن تجميع البرويتن في الوحدات الفرعية الريبوسومية.[27]
أجهزة أُخرى داخل النواة
[عدل]| اسم البنية | قطر البنية | |
|---|---|---|
| أجسام كاخال | 0.2–2.0 µm | [28] |
| PIKA | 5 µm | [29] |
| PML bodies | 0.2–1.0 µm | [30] |
| Paraspeckles | 0.2–1.0 µm | [31] |
| Speckles | 20–25 nm | [29] |
إلى جانب النويّة، تحتوي النواة على عددٍ من الأجسام غير المحددة بغشاء. تتضمن هذه الأجسام أجسامَ كاخال وأجسام الجوزاء الملتفة وتجمع الأجسام النووية البينية متعددة الأشكال PIKA وأجسام ابيضاض السلائف النقويّة PML واللطخات المتناظرة واللطخات المترابطة. وعلى الرغم من أن المعروف حول هذه الأجزاء قليل، إلا أن أهميتها تنبع من كونها تفسر وجود وحدات فرعية مُكوِّنة للنواة وأن جِبلة النواة غير خليطاً متجانساً.[30]
تظهر بعض البُنى النووية الفرعية كجزءٍ من عمليات مرضية غير طبيعية. على سبيل المثال، ظهور قضبان داخل نووية صغيرة في بعض حالات الاعتلال العضلي الخيطي. هذه الحالة تنجم عن طفرة في الأكتين، وهذه القضبان تتألف من الأكتين الطافر بالإضافة إلى البروتينات الهيكلية الخلوية الأخرى.[32]
أجسام كاخال
[عدل]تحتوي النواة على 1 إلى 10 بنى مُدمجة تُدعى أجسام كاخال أوالأجسام الملتفة، ويتراوح قطرها بين 0.2 إلى 2 ميكرومتر، ويعتمد قطرها على نوع الخلية والنوع الحيوي.[28] تأخذ هذه الأجسام شكل كرات مترابطة تحت المجهر الإلكتروني.[29] وهذه الأجسام عبارة عن كثافة من بروتين الكولين.[33] تشارك أجسام كاخال في أدوار مختلفة في معالجة الرنا RNA ولاسيّما إنضاج رنا النوية الصغير ورنا النووي الصغير، وتعديل هستونات رنا المرسال mRNA.[28]
وعلى غرار أجسام كاخال تبدو أجسام الجوزاء الملتفة، والتي اشتُقَّ اسمها من برج الجوزاء، إشارةً إلى علاقتها التوءمية مع أجسام كاخال. تتماثل أجسام كاخال وأجسام الجوزاء بالحجم والشكل، وتقريباً لا يمكن التمييز بينهما تحت المجهر.[33] إلا أنه على عكس أجسام كاخال فإن أجسام الجوزاء لا تحتوي على بروتينات ريبونووية صغيرة ولكن تحتوي على بروتين بقاء العصبونات المحركة، والذي ترتبط وظيفته بتخليق البروتين الريبونووي الصغير السابق الذكر.[34] اِقتُرح بناءً على الدراسة المجهرية كون أجسام كاخال وأجسام الجوزاء مظهرين مختلفين للبنية ذاتها.[33] إلا أن دراسات بنيوية لاحقة أظهرت تطابقهما باستثناء وجود اختلاف في البنية متعلق بمركب الكولين، حيث أجسام كاخال تحتوي على بروتين بقاء العصبونات المحركة وبروتين الكولين، أما أجسام الجوزاء فتحتوي على بروتين بقاء العصبونات المحركة فيما لا تحتوي على بروتين الكولين.[35]
تجمعات الجسيمات النووية البينية متعددة الأشكال
[عدل]وُصِفت تجمعات الجسيمات النووية البينية متعددة الأشكال RAFA للمرة الأولى في دراسات مجهرية أُجريت عام 1991. لا تزال وظيفتها غير واضحة، إلا أنه يُعتقد عدم وجود علاقة لها بتضاعف الدنا النشيط، أو النسخ أومعالجة الرنا.[36] في كثير من الأحيان تُوجد RAFA مقترنة بجسيمات تدعى محددة بتوضع كثيف لعامل النسخ PTF، والذي يعزز نسخ الرنا النووي الصغير.[37]
أجسام ابيضاض السلائف النقوية
[عدل]أجسام كروية تُوجد منتشرة في جميع أنحاء جِبلة النواة، وتقيس حوالي 0.1 إلى 1 ميكرومتر. تُعرف أيضاً بأجسام كريمر. توجد في النوية أيضاً مرتبطة بأجسام كاخال وأجسام الانقسام.[30] تنتمي أجسام ابيضاض السلائف النقوية للمصفوفة النووية أوالمطرق النووي.[38]
اللطخات المرتبطة
[عدل]اللطخات المترابطة بنى موجودة داخل النواة تتقوّى في مرحلة ما قبل ربط عوامل رنا المرسال، وتقع هذه اللطخات في المناطق داخل الكروماتينية في البلازما النووية في خلايا الثدييّات. وتحت المجهر الفلوري تظهر هذه اللطخات غير منتظمةٍ، على شكل بنى منقّطة، تتنوع في الحجم والشكل، وعند فحصها بالمجهر الإلكتروني تظهر على شكل عناقيد من الحبيبات داخل الكروماتينية. هذه اللطخات هي بُنى ديناميكية، وكُلٌّ من البروتين وبروتين الرنا يمكنه الدوران بين اللطخات وبنى النواة الأخرى، بما في ذلك مواقع النسخ. وقد وفّرت الدراسات التي أُقيمت حول تكوين وسلوك البقع فهماً لنموذج التقسيم الوظيفي الذي تقوم به النواة وطريقة تنظيم التعبير الجيني.[39] ربط البروتينات الريبونووية الصغيرة.[40][41] والبروتينات الرابطة الأخرى اللازمة لمعالجة ما قبل الرنا المرسال.[42] يتغير تكوين وموقع هذه البنى تبعاً لنسخ الرنا المرسال والتنظيم عبر فسفرة أنواع معينة من البروتينات، وذلك نظراً لتغير متطلبات الخلية المتغيرة.[43]
اللطخات المتناظرة
[عدل]اِكتُشِفَت من قبل فوكس وآخرين عام 2002، وتبدو اللطخات المتناظرة بشكل حجرات غير منتظمة الشكل في النواة في المساحة داخل الكروماتينية.[44] وقد وُثِّقت هذه البنى للمرة الأولى في خلايا هيلا، حيث ظهر 10 إلى 30 لكل نواة[45]، توجد هذه اللطخات المتناظرة في جميع الخلايا البشرية الأساسية، خطوط الخلايا المتحولة، والمقاطع النسيجية.[46] تُشير كلمة «اللطخات» إلى لطخات المرتبطة التي تكون قريبة من بعضها دائماً، أما كلمة «المتناظرة» فتشير إلى توضعها في النواة.[45]
تُعتبر اللطخات المتناظرة بنىً ديناميكية تتنبه وتستجيب لتغيرات النشاط الأيضي الخلوي. كما وتختفي اللطخات الصفراء عند غياب رنا بوليميراز 2 وتشكل حينها جميع مكونات البروتينات شكلاً هلالياً محيطياً في النواة، تظهر هذه الحادثة أثناء الدورة الخلوية. في الدورة الخلوية، تتواجد اللطخات الصفراء خلال الطور البيني وطيلة الانقسام الخيطي أو التفتلي باستثناء الطور النهائي. ففي خلال الطور النهائي، عندما تتشكل نواتان ابنتان، لا يتم نسخ رنا بوليميراز 2 لذا تشكّل مكونات البروتينات بدلاً من اللطخات شكل غطاء حول نووي.[46]
الألياف المحيطة بالكروماتين
[عدل]تظهر الألياف المحيطة بالكروماتين مرئيةً تحت المجهر الإلكتروني. وهي تقع بجوار الكروماتين النشط في النسخ، ويفترض أن تكون محددة لحجم المواقع النشطة في نسخ طليعة رنا المرسال.[46]
الوظيفة
[عدل]توفّر النواة موقعاً لنسخ الجينات منفصلاً عن موقع الترجمة في السيتوبلازما، مما يتيح مستويات تنظيمية للجينات غير متوفرة في بدائيات النوى. الوظيفة الأساسية لنواة الخلية هي التحكم في التعبير الجيني، والتوّسط في نسخ الدنا خلال دورة الخلية.
تتواجد النواة كعضية داخل حقيقيات النوى، مغشّاةً بغشاء مغلق تماماً، يحتوي على معظم المادة الوراثية للخلية. ويتم تنظيم جزيئات الحمض النووي الدنا، جنباً إلى جنب مع مجموعة متنوعة من البروتينات، لتشكيل الكروموسومات.
التقسيم الخلوي
[عدل]يسمح الغلاف النووي بالتحكم بالعناصر داخل النواة، ويفصلها عن بقية السيتوبلازما، متى ما كان هذا الأمر ضرورياً. وتكمن أهمية هذا الأمر في التحكّم بالعمليات على جانبي الغشاء النووي. في معظم الحالات التي تحتاج فيها العمليات السيتوبلازمية إلى تثبيط، ينتقل حينها إلى النواة، حيث يتفاعل مع عوامل النسخ لتخفيض إنتاج إنزيمات معينة في المسار. تحدث هذه الآلية التنظيمية في حالة تحلل الجلوكوز، من أجل تشكيل جلوكوز-6-فوسفات بدءاً من الجلوكوز. في التراكيز العالية للفركتوز-6-فوسفات، وهو جزيء لاحق يتشكل من الجلوكوز-6-فوسفات، وهو أيضاً عامل منظم ينقل الهكسوكيناز إلى النواة.[47] حيث تشكل هناك معقّداً مع بروتينات نووية للتقليل من التعبير عن الجينات المشاركة في تحلل السكر.[48]
من أجل التحكّم في الجينات التي يتم ترجمتها، تنشر الخلية بعض عوامل الترجمة البروتينية، وهي مسؤولة عن تنظيم التعبير الجيني، بدءاً من الوصول الفيزيائي إلى الدنا، حتّى يتم تفعيل جزيئات دنا عبر مسارات الإشارة المختلفة. وهذا يمنع حتى المستويات المنخفضة من التعبير الجيني غير المناسب. على سبيل المثال، في حالة جينات «العامل النووي المعزز لسلسلة كابا الخفيفة في الخلايا البائية النشطة» NF-kB التي تشارك في معظم الاستجابات الالتهابية، تكون ترجمتها مُضمّنَةً في استجابة إحدى مسارات الإشارة، كتلك التي يبدأها جزيء عامل نخر الورم ألفا TNFα، الذي يرتبط بمستقبلات غشاء الخلية، مؤدّيَةً إلى تجنيد بروتينات إشارة، وفي النهاية تفعيل عامل النسخ NF-kB. تؤدي الإشارة المحلية على NF-kB إلى نقلها عبر مسامِ نووي إلى النواة، حيث تحفّز نسخ الجينات المستهدفة.[7]
تقسيم الخلية إلى حجرتين يمنع ترجمة رنا مرسال غير المتزاوج.[49] رنا المرسال الخاص بحقيقيات النواة يحتوي إنترونات يجب إزالتها قبل الشروع بترجمتها لإنتاج بروتينات وظيفية. يتم التزاوج داخل النواة قبل أن يتم إتاحة الوصول إلى رنا مرسال من قبل الريبوسومات من أجل الترجمة. بدون النواة، لكانت الريبوسومات ستترجم رنا مرسال غير المعالج، مما يؤدي إلى بروتينات تالفة وغير وظيفية.
التعبير الجيني
[عدل]يتضمن التعبير الجيني أولاً النسخ، والذي فيه يتم استخدام دنا كقالب لإنتاج الحمض النووي الريبي. في حالة الجينات المرمّزة لبروتينات، فإن رنا RNA المنتج منها هورنا مرسال mRNA، الذي يحتاج فيما بعد إلى ترجمة بواسطة ريبوسومات ليُكوِّن بروتيناً. تقع الريبوسومات خارج النواة، لذا فإن رنا مرسال المنتج يحتاج إلى إخراجه من النواة.[50]
زيادةً على كون النواة موقع النسخ، فإنها تحتوي أيضاً على طيف واسع من البروتينات التي إما أن تتواسط مباشرةً في الترجمة، أوتشترك في تنظيم هذه العملية. وتشتمل هذه البروتينات على هيليكاز، وهي مجموعة بروتينات تَحل جزيئة الدنا ثنائية الطاق المجدولة، لتُسَهِّل الوصول إليها، وتشتمل أيضاً على رنا بوليميراز الذي يرتبط بمجمع الدنا لتكوين جزيئة رنا المتنامية، وتشتمل أيضاً على التوبوإيزوميرازات، التي تغيِّر معدَّل لفّ الحمض النووي، مما يساعد على اللف أو الحل، كما هو الحال في العديد من العوامل التي تتواسط النسخ وتنظم التعبير.[51]
معالجة ما قبل الحمض النووي الريبوزي المرسال
[عدل]تُعرف جزيئات الحمض النووي الريبوزي رنا قبل المعالجة بالنسخة الأولى من الرنا أو الرنا غير الناضجة. يجب أن تخضع هذه الجزيئات لعملية معالجة في النواة قبل تصديرها إلى السيتوبلازما، حيث أن الحمض النووي الريبوزي منقوص الأوكسجين الرنا التي تظهر في السيتوبلازما بدون هذه التعديلات، تتدرّك فيما بعد بدلاً من استخدامها في ترجمة البروتين. وأثناء ذلك ترتبط رنا المرسال مع مجموعة من البروتينات، لتشكّل تجمعات تدعى الجسيمات الريبونوكليوبروتينية غير المتجانسة.
يتم ربط الرنا، بواسطة معقّد يدعى جسيم التضفي، عبر عملية يتم فيها إزالة الإنترونات أو المناطق من دنا التي لا ترمّز بروتينا، تزال من النسخة الأولية من الرنا، أما الإكسونات المتبقية تتصل فيما بينها لتعيد تشكيل جزيئة واحدة متواصلة.[6] العديد من جزيئات رنا المرسال الأولية، بما في ذلك الأجسام المضادة المرمِّزة، يمكن أن تتضفّر بعدّة طرق لإنتاج جزيئات رنا مرسال ناضجة، والتي بدورها تقوم بترميز سلاسل بروتين مختلفة. تُعرف هذه العملية بالوصل المتبادل، وتسمح هذه العملية بإنتاج بروتينات متنوعة جداً من كمية محدودة من دنا.
نواة لكل خلية
[عدل]معظم حقيقيات النوى تمتلك نواةً واحدة، وبعضها عديم النواة، في حين يمتلك البعض الآخر عدة نوى. ينجم هذا التنوع إما عن التطور الطبيعي كما في نضوج خلايا الدم الحمراء عند الثدييّات، أونتيجة انقسام خلوي خاطئ.
خلايا عديمة النواة
[عدل]
تفتقد الخلايا عديمة النواة أي نواة، أي أنها غير قادرة على الانقسام، وبالتالي غير قادرة على توليد خلايا جديدة. إحدى أكثر الخلايا عديمة النواة المعروفة عند الثدييّات هي خلايا الدم الحمراء، التي تفتقر أيضاً إلى ميتاكوندريا، حيث تقوم هذه الخلية بدور ناقل للأوكسجين من الرئتين إلى أنسجة الجسم. تنضج الكريات الحمر من سلائفها في نقي العظم، حيث تفقد نواتها والريبوسومات. تُطرد النواة خارج الخلية أثناء تحولها من أرومة حمراء إلى خلية شبكية، كما وتعتبر الخلية الشبكية الشكل السابق مباشرةً لكريات الدم الحمراء الناضجة في الدم.[52] يؤدي وجود بعض الطفرات إلى التحريض على إطلاق بعض الكريات الحمر غير الناضجة «صغيرة النواة» في مجرى الدم.[53][54] كما يمكن للخلايا عديمة النواة أ، تنشأ من انقسامِ معيب بحيث تفتقر إحدى الخلايا البنتين إلى النواة، فيما تمتلك الأخرى نواتين.
في النباتات المزهرة (كاسيات البذور)، تتواجد الخلايا في عناصر الأنبوب الغربالي.
الخلايا متعددة النوى
[عدل]تحتوي هذه الخلايا على عدة نوى. معظم الأنواع الأكانثريا من الأوليّات[55] وبعض الفطريات في الجذريات الفطرية[56] يمتلكون بالحالة الطبيعية خلايا عديدة النوى. ومن الأمثلة الأخرى عن الخلايا متعددة النوى الطفيليات المعوية في جنس الجيارديا، حيث تمتلك هذه الخلايا نواتين في كل خلية.[57] أما في البشر، فإن الخلايا العضلية الهيكلية التي تدعى الخلايا العضلية تكوِّن ما يعرف بالمُخلى الخلوي وهوبروتوبلازما متعددة النوى خلال التطور، ويسمح توضع النوى المتعددة محيطياً يسمح بمساحة أكبر في الخلية لِلييفات العضلية.[6] يمكن للخلايا ثنائية النواة أومتعددة النوى أن تكون غير طبيعية في البشر، على سبيل المثال الخلايا التي تنتج عن التحام وحيدات النوى والبالعات والتي تُعرف باسم الخلايا العملاقة متعددة النوى، والتي يصاحبها التهاب أحياناً[58] وتشارك في تشكيل الأورام.[59]
كذلك فإن عدداً من السوطيّات الدوّارة تمتلك نواتين.[60] وخلافاً للخلايا متعددة النوى الأخرى فإن هذه النواة تحتوي على سلالتين من الدنا DNA: واحدة من السوطيّة الدوارة والأخرى من الدياتوم التكافلي. تبقي ميتاكوندريا وصانعات الدياتوم على وظائفها بطريقة ما.
التطوّر
[عدل]اِعتُبِرت النواة السِمة المميّزة لحقيقيات النوى، وكان الأصل التطوّري للنواة موضوع كثير التكهنات. وقد ظهرت أربع فريضيّات رئيسية لتفسير وجود النواة، على الرغم من عدم حيازة أي فرضيّة منها على تأييد واسع النطاق.[61]
أول هذه النماذج هو «التغذية المتبادلة»، وهو نموذج يقترح وجود علاقة تكافلية بين العتائق والبكتيريا، أدّت لنشوء خلية حقيقية النواة، أي تحتوي على نواة. حيث لا تحتوي العتائق أو البكتيريا على نوى.[62] تقوم الفرضيّة على نشوء النواة عندما قامت عتيقة قديمة، مشابهة للعتيقة المولدة للميثان الحديثة، قامت بغزو بكتيريا وعاشت بداخلها، وهذه البكتيريا مشابهة لجرثومة مخاطية حديثة، وتشكّلت فيما بعد النواة الأولى. تشابه هذه النظرية نظرية منشأ ميتاكوندريا الخلية حقيقية النواة وكذلك الصانعات الخضراء وهي نظرية مقبولة، حيث يُعتقد تطورها من علاقة تعايشية داخلية بين حقيقيات النواة البدائية proto-eukaryotes وبكتيريا هوائية.[63] تدعم الملاحظات حول تماثل بعض جينات البروتينات في العتائق وحقيقيات النواة بما في ذلك الهستونات، تدعم هذه الملاحظات الأصل العتائقي للنواة.[64]
يقترح النموذج الثاني، أن الخلايا البدائية للحقيقية النواة تطورت من البكتيريا دون المرور بالمرحلة التكافلية الداخلية. تستند هذه الفرضية على وجود بكتيريا مستعلقات حديثة تمتلك بنية نووية مزودة بمسامٍ بدئية، بالإضافية إلى بُنى غشائية مجزأة أخرى.[65] وينص اقتراح مماثل أن خلية تشبه الخلية حقيقية النواة، وchronocyte قد تطوّرت أولاً، ومن ثم ولّدت المبتلعة العتيقة والبكتيريا النواة والخلية حقيقية النواة.[66]
تُعتبر فرضية تولُّد حقيقيات النوى الفيروسية، الفرضية الأكثر إثارةً للجدل. هذا النموذج يقوم على افتراض أن النواة المزودة بغشاء وكذلك بقيّة السمات المميّزة لحقيقيات النواة، قد نشأت من إصابة بدائيات النوى بفيروس. ويستند هذا الافتراض على أوجه التشابه بين حقيقيات النوى والفيروسات في الحمض النووي الريبي منقوص الأوكسجين الخطي والارتباط المحكم بالبروتينات (حيث تشابه الهستونات غلاف الفيروس)، حيث تطوّرت النواة في إطار تشكيل «مفترسات» خلوية مبكرة.[67] كذلك رأي آخر افترض نشوء حقيقيات النواة من عتائق مبكرة أُصيبت بفيروس الجدري، وذلك بناءً على التشابه الملحوظ بين بلمرة الحمض النووي DNA في فيروس الجدري الحديث وحقيقيات النوى.[68][69] وقد أُشِيرَ إلى ارتباط ما قد يكون بين مسألة تطور التكاثر الجنسي وفرضية إنتاج حقيقيات النوى الفيروسية.[70]
مقترح أحدث، يُدعى بفرضية الغشاء الخارجي، التي تشير إلى أن النواة نشأت من خلية سليفة واحدة قامت بتطوير غشاء ثاني خارجي. الغشاء الداخلي الذي كان محيطاً بالخلية الأصلية تحوّل إلى غشاء نووي وطوّر بشكل متزايد بنى مساميّة من أجل تمرير المكونات الخلوية المصنّعة داخلياً مثل الوحدات الفرعية الريبوسومية.[71]
المعرض
[عدل]-
مقارنة بين كرموسومات الإنسان والشمبانزي.
-
أقاليم الكروموسوم عند الفأر في خلايا مختلفة.
-
مناطق الكروموسومات الـ 24 (المناطق) في خلايا الإنسان.
مواضيع متعلقة
[عدل]قراءات إضافية
[عدل]- A review article about nuclear lamins, explaining their structure and various roles
- Görlich، Dirk؛ Kutay، U (1999). "Transport between the cell nucleus and the cytoplasm". Annu. Rev. Cell Dev. Biol. ج. 15: 607–660. DOI:10.1146/annurev.cellbio.15.1.607. PMID:10611974.
- A review article about nuclear transport, explains the principles of the mechanism, and the various transport pathways
- Lamond، Angus I.؛ Earnshaw، WC (24 أبريل 1998). "Structure and Function in the Nucleus". Science. ج. 280 ع. 5363: 547–553. DOI:10.1126/science.280.5363.547. PMID:9554838.
- A review article about the nucleus, explaining the structure of chromosomes within the organelle, and describing the nucleolus and other subnuclear bodies
- Pennisi E. (2004). "Evolutionary biology. The birth of the nucleus". Science. ج. 305 ع. 5685: 766–768. DOI:10.1126/science.305.5685.766. PMID:15297641.
- A review article about the evolution of the nucleus, explaining a number of different theories
- Pollard، Thomas D.؛ William C. Earnshaw (2004). Cell Biology. Philadelphia: Saunders. ISBN:0-7216-3360-9.
- A university level textbook focusing on cell biology. Contains information on nucleus structure and function, including nuclear transport, and subnuclear domains
روابط إضافية
[عدل]- MBInfo - The Nucleus
- cellnucleus.com موقع يغطي بنية ووظيفة النواة من قسم الأورام في جامعة ألبرتا.
- http://npd.hgu.mrc.ac.uk/user/?page=compartment The Nuclear Protein Database] معلومات عن مكونات النُويِّة.
- مجموعة النواة في مكتبة الصور والفيديو التابعة of The للجمعية الأميركية لبيولوجيا الخلية تحتوي على صور ثابتة ومقاطع فيديوتوضح النواة
- Nuclear Envelope and Nuclear Import Section from Landmark Papers in Cell Biology, Joseph G. Gall, J. Richard McIntosh, eds., تحتوي على تعليقات رقمية وروابط لأورق بحثية أساسية على النواة نُشرت على الإنترنت في مكتبة الصور والفيديو التابعة للجمعية الأميركية لبيولوجيا الخلية
- نماذج سيتوبلاسمية ناتجة عن أجسام مضادة بشرية
مراجع
[عدل]- ^ مذكور في: Gene Ontology release 2019-10-07. الوصول: 12 أكتوبر 2019. مُعرِّف علم وجود المورثات (GO): GO:0005634. تاريخ النشر: 7 أكتوبر 2019.
- ^ Leeuwenhoek, A. van: Opera Omnia, seu Arcana Naturae ope exactissimorum Microscopiorum detecta, experimentis variis comprobata, Epistolis ad varios illustres viros. J. Arnold et Delphis, A. Beman, Lugdinum Batavorum 1719–1730. Cited after: Dieter Gerlach, Geschichte der Mikroskopie. Verlag Harri Deutsch, Frankfurt am Main, Germany, 2009. ISBN 978-3-8171-1781-9.
- ^ Harris، H (1999). The Birth of the Cell. New Haven: Yale University Press. ISBN:0-300-07384-4. مؤرشف من الأصل في 2019-12-17.
- ^ Brown، Robert (1866). "On the Organs and Mode of Fecundation of Orchidex and Asclepiadea". Miscellaneous Botanical Works I: 511–514.
- ^ ا ب Cremer، Thomas (1985). Von der Zellenlehre zur Chromosomentheorie. Berlin, Heidelberg, New York, Tokyo: Springer Verlag. ISBN:3-540-13987-7. Online Version cremer.de/main_de/cremer/personen/info_T_Cremer.htm#book here
- ^ ا ب ج د ه و ز Lodish، H؛ Berk A؛ Matsudaira P؛ Kaiser CA؛ Krieger M؛ Scott MP؛ Zipursky SL؛ Darnell J. (2004). Molecular Cell Biology (ط. 5th). New York: WH Freeman. ISBN:0-7167-2672-6.
- ^ ا ب ج د Bruce Alberts؛ Alexander Johnson؛ Julian Lewis؛ Martin Raff؛ Keith Roberts؛ Peter Walter، المحررون (2002). Molecular Biology of the Cell, Chapter 4, pages 191–234 (ط. 4th). Garland Science.
- ^ Clegg JS (فبراير 1984). "Properties and metabolism of the aqueous cytoplasm and its boundaries". Am. J. Physiol. ج. 246 ع. 2 Pt 2: R133–51. PMID:6364846. مؤرشف من view=reprint&pmid=6364846 الأصل في 2020-05-04.
{{استشهاد بدورية محكمة}}: تحقق من قيمة|مسار=(مساعدة) - ^ ا ب Paine P، Moore L، Horowitz S (1975). "Nuclear envelope permeability". Nature. ج. 254 ع. 5496: 109–114. DOI:10.1038/254109a0. PMID:1117994.
- ^ Rodney Rhoades؛ Richard Pflanzer، المحررون (1996). "Ch3". Human Physiology (ط. 3rd). Saunders College Publishing. مؤرشف من الأصل في 2022-03-19.
- ^ Shulga N، Mosammaparast N، Wozniak R، Goldfarb D (2000). "Yeast nucleoporins involved in passive nuclear envelope permeability". J Cell Biol. ج. 149 ع. 5: 1027–1038. DOI:10.1083/jcb.149.5.1027. PMC:2174828. PMID:10831607.
- ^ Pemberton L، Paschal B (2005). "Mechanisms of receptor-mediated nuclear import and nuclear export". Traffic. ج. 6 ع. 3: 187–198. DOI:10.1111/j.1600-0854.2005.00270.x. PMID:15702987.
- ^ Stuurman N، Heins S، Aebi U (1998). "Nuclear lamins: their structure, assembly, and interactions". J Struct Biol. ج. 122 ع. 1–2: 42–66. DOI:10.1006/jsbi.1998.3987. PMID:9724605.
- ^ Goldman A، Moir R، Montag-Lowy M، Stewart M، Goldman R (1992). "Pathway of incorporation of microinjected lamin A into the nuclear envelope". J Cell Biol volume = 119 ع. 4: 725–735. DOI:10.1083/jcb.119.4.725. PMC:2289687. PMID:1429833.
{{استشهاد بدورية محكمة}}: عمود مفقود في:|صحيفة=(مساعدة) - ^ Goldman R، Gruenbaum Y، Moir R، Shumaker D، Spann T (2002). "Nuclear lamins: building blocks of nuclear architecture". Genes Dev. ج. 16 ع. 5: 533–547. DOI:10.1101/gad.960502. PMID:11877373. مؤرشف من الأصل في 2007-09-27.
- ^ Moir RD، Yoona M، Khuona S، Goldman RD (2000). "Nuclear Lamins A and B1: Different Pathways of Assembly during Nuclear Envelope Formation in Living Cells". Journal of Cell Biology. ج. 151 ع. 6: 1155–1168. DOI:10.1083/jcb.151.6.1155. PMC:2190592. PMID:11121432.
- ^ Spann TP, Goldman AE, Wang C, Huang S, Goldman RD. (2002). "Alteration of nuclear lamin organization inhibits RNA polymerase II–dependent transcription". Journal of Cell Biology. ج. 156 ع. 4: 603–608. DOI:10.1083/jcb.200112047. PMC:2174089. PMID:11854306.
- ^ Mounkes LC، Stewart CL (2004). "Aging and nuclear organization: lamins and progeria". Current Opinion in Cell Biology. ج. 16 ع. 3: 322–327. DOI:10.1016/j.ceb.2004.03.009. PMID:15145358.
- ^ Ehrenhofer- Murray A (2004). "Chromatin dynamics at DNA replication, transcription and repair". Eur J Biochem. ج. 271 ع. 12: 2335–2349. DOI:10.1111/j.1432-1033.2004.04162.x. PMID:15182349.
- ^ Grigoryev S، Bulynko Y، Popova E (2006). "The end adjusts the means: heterochromatin remodelling during terminal cell differentiation". Chromosome Res. ج. 14 ع. 1: 53–69. DOI:10.1007/s10577-005-1021-6. PMID:16506096.
- ^ Schardin، Margit؛ Cremer، T؛ Hager، HD؛ Lang، M (December 1985). "Specific staining of human chromosomes in Chinese hamster x man hybrid cell lines demonstrates interphase chromosome territories". Human Genetics. Springer Berlin / Heidelberg. ج. 71 ع. 4: 281–287. DOI:10.1007/BF00388452. PMID:2416668. مؤرشف من الأصل في 11 مايو 2020. اطلع عليه بتاريخ أغسطس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ Lamond، Angus I.؛ William C. Earnshaw (24 أبريل 1998). "Structure and Function in the Nucleus". Science. ج. 280 ع. 5363: 547–553. DOI:10.1126/science.280.5363.547. PMID:9554838.
- ^ Kurz، A؛ Lampel، S؛ Nickolenko، JE؛ Bradl، J؛ Benner، A؛ Zirbel، RM؛ Cremer، T؛ Lichter، P (1996). "Active and inactive genes localize preferentially in the periphery of chromosome territories". The Journal of Cell Biology. The Rockefeller University Press. ج. 135 ع. 5: 1195–1205. DOI:10.1083/jcb.135.5.1195. PMC:2121085. PMID:8947544. مؤرشف من الأصل في 2008-01-25.
- ^ NF Rothfield؛ BD Stollar (1967). "The Relation of Immunoglobulin Class, Pattern of Antinuclear Antibody, and Complement-Fixing Antibodies to DNA in Sera from Patients with Systemic Lupus Erythematosus". J Clin Invest. ج. 46 ع. 11: 1785–1794. DOI:10.1172/JCI105669. PMC:292929. PMID:4168731.
- ^ S Barned؛ AD Goodman؛ DH Mattson (1995). "Frequency of anti-nuclear antibodies in multiple sclerosis". Neurology. ج. 45 ع. 2: 384–385. DOI:10.1212/WNL.45.2.384. PMID:7854544.
- ^ Hernandez-Verdun، Daniele (2006). "Nucleolus: from structure to dynamics". Histochem. Cell. Biol. ج. 125 ع. 1–2: 127–137. DOI:10.1007/s00418-005-0046-4. PMID:16328431.
- ^ ا ب Lamond، Angus I.؛ Judith E. Sleeman (أكتوبر 2003). "Nuclear substructure and dynamics". current biology. ج. 13 ع. 21: R825–828. DOI:10.1016/j.cub.2003.10.012. PMID:14588256.
- ^ ا ب ج Cioce M، Lamond A (2005). "Cajal bodies: a long history of discovery". Annu Rev Cell Dev Biol. ج. 21: 105–131. DOI:10.1146/annurev.cellbio.20.010403.103738. PMID:16212489.
- ^ ا ب ج Pollard، Thomas D.؛ William C. Earnshaw (2004). Cell Biology. Philadelphia: Saunders. ISBN:0-7216-3360-9.
- ^ ا ب ج Dundr، Miroslav؛ Tom Misteli (2001). "Functional architecture in the cell nucleus". Biochem. J. ج. 356 ع. Pt 2: 297–310. DOI:10.1042/0264-6021:3560297. PMC:1221839. PMID:11368755.
- ^ Fox، Archa (7 مارس 2007). "Paraspeckle Size" (Interview). R. Sundby. E-mail Correspondence.[هل المصدر موثوق به؟]
- ^ Goebel، H.H.؛ I Warlow (يناير 1997). "Nemaline myopathy with intranuclear rods—intranuclear rod myopathy". Neuromuscular Disorders. ج. 7 ع. 1: 13–19. DOI:10.1016/S0960-8966(96)00404-X. PMID:9132135.
- ^ ا ب ج Matera AG، Frey MA (1998). "Coiled Bodies and Gems: Janus or Gemini?". American Journal of Human Genetics. ج. 63 ع. 2: 317–321. DOI:10.1086/301992. PMC:1377332. PMID:9683623.
- ^ Matera، A. Gregory (1998). "Of Coiled Bodies, Gems, and Salmon". Journal of Cellular Biochemistry. ج. 70 ع. 2: 181–192. DOI:10.1002/(sici)1097-4644(19980801)70:2<181::aid-jcb4>3.0.co;2-k. PMID:9671224.
- ^ Saunders WS، Cooke CA، Earnshaw WC (1991). "Compartmentalization within the nucleus: discovery of a novel subnuclear region". Journal of Cellular Biology. ج. 115 ع. 4: 919–931. DOI:10.1083/jcb.115.4.919. PMC:2289954. PMID:1955462.
- ^ Pombo A، Cuello P، Schul W، Yoon J، Roeder R، Cook P، Murphy S (1998). "Regional and temporal specialization in the nucleus: a transcriptionally active nuclear domain rich in PTF, Oct1 and PIKA antigens associates with specific chromosomes early in the cell cycle". The EMBO Journal. ج. 17 ع. 6: 1768–1778. DOI:10.1093/emboj/17.6.1768. PMC:1170524. PMID:9501098.
- ^ Lallemand-Breitenbach، V.؛ De The، H. (2010). "PML Nuclear Bodies". Cold Spring Harbor Perspectives in Biology. ج. 2 ع. 5: a000661. DOI:10.1101/cshperspect.a000661. PMC:2857171. PMID:20452955.
- ^ Lamond AI، Spector DL (أغسطس 2003). "Nuclear speckles: a model for nuclear organelles". Nature Reviews Molecular Cell Biology. ج. 4 ع. 8: 605–12. DOI:10.1038/nrm1172. PMID:12923522.
- ^ Tripathi K، Parnaik VK (سبتمبر 2008). "Differential dynamics of splicing factor SC35 during the cell cycle" (PDF). J. Biosci. ج. 33 ع. 3: 345–54. DOI:10.1007/s12038-008-0054-3. PMID:19005234. مؤرشف من الأصل (PDF) في 2018-08-15.
- ^ Tripathi، K.؛ Parnaik، V. K. (2008). "Differential dynamics of splicing factor SC35 during the cell cycle". Journal of biosciences. ج. 33 ع. 3: 345–354. DOI:10.1007/s12038-008-0054-3. PMID:19005234.
- ^ Lamond AI، Spector DL (أغسطس 2003). "Nuclear speckles: a model for nuclear organelles". Nature Reviews Molecular Cell Biology. ج. 4 ع. 8: 605–12. DOI:10.1038/nrm1172. PMID:12923522.
- ^ Handwerger، Korie E.؛ Joseph G. Gall (يناير 2006). "Subnuclear organelles: new insights into form and function". TRENDS in Cell Biology. ج. 16 ع. 1: 19–26. DOI:10.1016/j.tcb.2005.11.005. PMID:16325406.
- ^ Fox, Archa؛ Lam، YW؛ Leung، AK؛ Lyon، CE؛ Andersen، J؛ Mann، M؛ Lamond، AI (2002). "Paraspeckles:A Novel Nuclear Domain". Current Biology. ج. 12 ع. 1: 13–25. DOI:10.1016/S0960-9822(01)00632-7. PMID:11790299. مؤرشف من الأصل في 2021-04-30.[وصلة مكسورة]
- ^ ا ب Fox، Archa؛ Wendy Bickmore (2004). "Nuclear Compartments: Paraspeckles". Nuclear Protein Database. مؤرشف من الأصل في 2009-07-24. اطلع عليه بتاريخ 2007-03-06.[وصلة مكسورة]
- ^ ا ب ج Fox, A.؛ وآخرون (2005). "P54nrb Forms a Heterodimer with PSP1 That Localizes to Paraspeckles in an RNA-dependent Manner". Molecular Biology of the Cell. ج. 16 ع. 11: 5304–5315. DOI:10.1091/mbc.E05-06-0587. PMC:1266428. PMID:16148043. مؤرشف من الأصل في 2007-09-27. اطلع عليه بتاريخ 2017-08-01.
- ^ Lehninger، Albert L.؛ Nelson, David L.؛ Cox, Michael M. (2000). Lehninger principles of biochemistry (ط. 3rd). New York: Worth Publishers. ISBN:1-57259-931-6.
- ^ Moreno F، Ahuatzi D، Riera A، Palomino CA، Herrero P (2005). "Glucose sensing through the Hxk2-dependent signalling pathway". Biochem Soc Trans. ج. 33 ع. 1: 265–268. DOI:10.1042/BST0330265. PMID:15667322.
- ^ G?rlich، Dirk؛ Ulrike Kutay (1999). "Transport between the cell nucleus and the cytoplasm". Annu. Rev. Cell Dev. Biol. ج. 15 ع. 1: 607–660. DOI:10.1146/annurev.cellbio.15.1.607. PMID:10611974.
- ^ Nierhaus، Knud H.؛ Daniel N. Wilson (2004). Protein Synthesis and Ribosome Structure: Translating the Genome. Wiley-VCH. ISBN:3-527-30638-2.
- ^ Nicolini، Claudio A. (1997). Genome Structure and Function: From Chromosomes Characterization to Genes Technology. Springer. ISBN:0-7923-4565-7.
- ^ Skutelsky، E.؛ Danon D. (يونيو 1970). "Comparative study of nuclear expulsion from the late erythroblast and cytokinesis". J Cell Biol. ج. 60 ع. 60(3): 625–635. DOI:10.1016/0014-4827(70)90536-7. PMID:5422968.
- ^ Torous، DK؛ Dertinger SD؛ Hall NE؛ Tometsko CR. (2000). "Enumeration of micronucleated reticulocytes in rat peripheral blood: a flow cytometric study". Mutat Res. ج. 465 ع. 465(1–2): 91–99. DOI:10.1016/S1383-5718(99)00216-8. PMID:10708974.
- ^ Hutter، KJ؛ Stohr M. (1982). "Rapid detection of mutagen induced micronucleated erythrocytes by flow cytometry". Histochemistry. ج. 75 ع. 3: 353–362. DOI:10.1007/bf00496738. PMID:7141888.
- ^ Zettler، LA؛ Sogin ML؛ Caron DA (1997). "Phylogenetic relationships between the Acantharea and the Polycystinea: A molecular perspective on Haeckel's Radiolaria". Proc Natl Acad Sci USA. ج. 94 ع. 21: 11411–11416. DOI:10.1073/pnas.94.21.11411. PMC:23483. PMID:9326623.
- ^ Horton، TR (2006). "The number of nuclei in basidiospores of 63 species of ectomycorrhizal Homobasidiomycetes". Mycologia. ج. 98 ع. 2: 233–238. DOI:10.3852/mycologia.98.2.233. PMID:16894968.
- ^ Adam RD (ديسمبر 1991). "The biology of Giardia spp". Microbiol. Rev. ج. 55 ع. 4: 706–32. PMC:372844. PMID:1779932. مؤرشف من الأصل في 2020-03-08.
- ^ McInnes، A؛ Rennick DM (1988). "Interleukin 4 induces cultured monocytes/macrophages to form giant multinucleated cells". J Exp Med. ج. 167 ع. 2: 598–611. DOI:10.1084/jem.167.2.598. PMC:2188835. PMID:3258008.
- ^ Goldring، SR؛ Roelke MS؛ Petrison KK؛ Bhan AK (1987). "Human giant cell tumors of bone identification and characterization of cell types". J Clin Invest. ج. 79 ع. 2: 483–491. DOI:10.1172/JCI112838. PMC:424109. PMID:3027126.
- ^ Imanian، B؛ Pombert، JF؛ Dorrell، RG؛ Burki، F؛ Keeling، PJ (2012). "Tertiary endosymbiosis in two dinotoms has generated little change in the mitochondrial genomes of their dinoflagellate hosts and diatom endosymbionts". PLOS ONE. ج. 7 ع. 8: e43763. DOI:10.1371/journal.pone.0043763. PMC:3423374. PMID:22916303.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Pennisi E. (2004). "Evolutionary biology. The birth of the nucleus". Science. ج. 305 ع. 5685: 766–768. DOI:10.1126/science.305.5685.766. PMID:15297641.
- ^ C.Michael Hogan. 2010. Archaea. eds. E.Monosson & C.Cleveland, Encyclopedia of Earth. National Council for Science and the Environment, Washington DC. نسخة محفوظة 08 يونيو 2013 على موقع واي باك مشين.
- ^ Margulis, Lynn (1981). Symbiosis in Cell Evolution. San Francisco: W. H. Freeman and Company. ص. 206–227. ISBN:0-7167-1256-3. مؤرشف من الأصل في 2019-12-17.
- ^ Lopez-Garcia P، Moreira D (2006). "Selective forces for the origin of the eukaryotic nucleus". BioEssays. ج. 28 ع. 5: 525–533. DOI:10.1002/bies.20413. PMID:16615090.
- ^ Fuerst JA. (2005). "Intracellular compartmentation in planctomycetes". Annu Rev Microbiol. ج. 59: 299–328. DOI:10.1146/annurev.micro.59.030804.121258. PMID:15910279.
- ^ Hartman H، Fedorov A (2002). "The origin of the eukaryotic cell: a genomic investigation". Proc Natl Acad Sci U S A. ج. 99 ع. 3: 1420–1425. DOI:10.1073/pnas.032658599. PMC:122206. PMID:11805300.
- ^ Bell PJ (سبتمبر 2001). "Viral eukaryogenesis: was the ancestor of the nucleus a complex DNA virus?". J. Mol. Evol. ج. 53 ع. 3: 251–6. DOI:10.1007/s002390010215. PMID:11523012. مؤرشف من الأصل في 2022-06-21.
- ^ Takemura M (2001). "Poxviruses and the origin of the eukaryotic nucleus". J Mol Evol. ج. 52 ع. 5: 419–425. DOI:10.1007/s002390010171. PMID:11443345. مؤرشف من الأصل في 2022-06-23.
- ^ Villarreal L، DeFilippis V (2000). "A hypothesis for DNA viruses as the origin of eukaryotic replication proteins". J Virol. ج. 74 ع. 15: 7079–7084. DOI:10.1128/JVI.74.15.7079-7084.2000. PMC:112226. PMID:10888648.
- ^ Bell PJ (نوفمبر 2006). "Sex and the eukaryotic cell cycle is consistent with a viral ancestry for the eukaryotic nucleus". J. Theor. Biol. ج. 243 ع. 1: 54–63. DOI:10.1016/j.jtbi.2006.05.015. PMID:16846615.
- ^ de Roos AD (2006). "The origin of the eukaryotic cell based on conservation of existing interfaces". Artif Life. ج. 12 ع. 4: 513–523. DOI:10.1162/artl.2006.12.4.513. PMID:16953783.





