إيترافيرني
| إيترافيرني | |
|---|---|
| الاسم النظامي | |
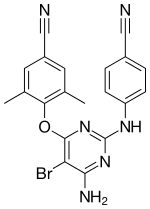
| 4-[6-Amino-5-bromo-2-[(4-cyanophenyl)amino] pyrimidin-4-yl]oxy-3,5-dimethylbenzonitrile | |
| يعالج | |
| اعتبارات علاجية | |
| اسم تجاري | Intelence |
| ASHPDrugs.com | أفرودة |
| مدلاين بلس | a608016 |
| الوضع القانوني | وكالة الأدوية الأوروبية:وصلة، إدارة الغذاء والدواء:وصلة |
| فئة السلامة أثناء الحمل | B1 (أستراليا) B (الولايات المتحدة) |
| طرق إعطاء الدواء | Oral |
| بيانات دوائية | |
| ربط بروتيني | 99.9% |
| استقلاب (أيض) الدواء | كبد (سيتوكروم 3A4، CYP2C9 & CYP2C19-mediated) |
| عمر النصف الحيوي | 41±20 hours |
| إخراج (فسلجة) | Faeces (93.7%), urine (1.2%) |
| معرّفات | |
| CAS | 269055-15-4 |
| ك ع ت | J05J05AG04 AG04 |
| بوب كيم | CID 193962 |
| ECHA InfoCard ID | 100.207.546 |
| درغ بنك | DB06414 |
| كيم سبايدر | 168313 |
| المكون الفريد | 0C50HW4FO1 |
| كيوتو | D04112 |
| ChEMBL | CHEMBL308954 |
| NIAID ChemDB | 105156 |
| بنك بيانات البروتين ligand ID | 65B (PDBe, RCSB PDB) |
| بيانات كيميائية | |
| الصيغة الكيميائية | C20H15BrN6O |
| الكتلة الجزيئية | 435.28 g/mol |
| تعديل مصدري - تعديل | |
إيترافيرني (ETR ، [2] الاسم التجاري Intelence ، المعروف سابقًا باسم (TMC125) هو عقار مضاد للفيروسات القهقرية (بالإنجليزية: antiretroviral drug) ومثبط انزيم المنتسخة العكسية اللانوكليوزيدي: (بالإنجليزية: non-nucleoside reverse transcriptase inhibitor) (NNRTI)، يستخدم لعلاج فيروس نقص المناعة البشرية؛ حيث يقوم بمنع الفيروس من التكاثر في الجسم. وتقوم شركة «تيبوتيك» Tibotec للبحوث الدوائية؛ وهي شركة تابعة لشركة جونسون آند جونسون بتسويق إيترافيرني. وافقت إدارة الغذاء والدواء في شهر يناير 2008 على استخدام إيترافيرني من قبل المرضى الذين يعانون من مقاومة ثابتة لأدوية أخرى، مما جعله الدواء الثلاثين لمكافحة فيروس نقص المناعة البشرية المعتمد في الولايات المتحدة؛ والدواء الأول الذي يتم اعتماده في عام 2008. ثم قامت كندا باعتماده لمرضاها في 1 أبريل 2008. يتم تصنيع إيترافيرني بترخيص كل من الولايات المتحدة وكندا وإسرائيل وروسيا وأستراليا والاتحاد الأوروبي، [3] ويخضع للمراجعة التنظيمية في سويسرا.[4]
المؤشرات والجرعة[عدل]
يشار إلى عقار إيترافيرني، بالاقتران مع مضادات الفيروسات القهقرية الأخرى، لعلاج عدوى فيروس العوز المناعي البشري من النوع 1 (HIV-1) في المرضى البالغين ذوي الخبرة في العلاج بمضادات الفيروسات القهقرية، والذين لديهم أدلة على التكاثر الفيروسي وسلالات فيروس العوز المناعي البشري -1 مثبطات النسخ العكسي للنيوكليوزيد (NNRTI) وعوامل أخرى مضادة للفيروسات العكوسة.
الجرعة الموصى بها من عقار إيترافيرني هي 200 ملغ (2 × 100) أقراص ملغ، أو 1 × 200 mg mg اعتبارا من 03/18/2011) يؤخذ مرتين يوميًا بعد الوجبة الغذائية. لا يؤثر نوع الطعام على التعرض للإيتافيرين.[5]
موانع[عدل]
يحتوي قرص إيترافيرني (100 ملغ) على 160 ملغ من اللاكتوز. لذلك على المرضى الذين يعانون من مشاكل وراثية نادرة من عدم تحمل الجلاكتوز أو نقص اللاكتاز أو سوء امتصاص الجلوكوز - الجلاكتوز ألا يتناولوا هذا الدواء.[6]
التحذيرات والمخاطر[عدل]
في عام 2009، تم تعديل المعلومات الموصوفة للإيترافيرين لتشمل «تقارير ما بعد البيع لحالات متلازمة ستيفنز جونسون، تنخر البشرة السمي والحمامي المتعددة الأشكال، فضلاً عن تفاعلات فرط الحساسية التي تتميز بالطفح الجلدي، والنتائج الدستورية، وأحيانًا اختلال وظائف الأعضاء، بما في ذلك فشل الكبد. يجب إيقاف علاج إنتلنس فور ظهور علامات وأعراض الجلد الشديد أو تفاعلات فرط الحساسية.» [7]
إعادة تموضع[عدل]
تمت دراسة إيتافيرين للاستخدام في تطبيق إعادة تموضع الدواء. في ورقة [8] نشرت في المنشور الطبي «حركة الاضطرابات»، تبين أن الإيتافيرين يؤثر على زيادة إنتاج الفراتاكسين. يُعتبر نقص فراتاكسين عنصراً أساسياً في ترنح فريدريك، وهو مرض وراثي يؤدي إلى فقدان تدريجي للتنسيق وقوة العضلات مما يؤدي إلى عجز في الحركة واستخدام بدوام كامل على كرسي متحرك.
المراجع[عدل]
- ^ Inxight: Drugs Database، QID:Q57664317
- ^ "Appendix A: Key to Acronyms". Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents. وزارة الصحة والخدمات البشرية. مؤرشف من الأصل في 2012-08-31.
- ^ "Intelence receives marketing authorisation in the European Union for HIV combination therapy". Tibotec. مؤرشف من الأصل في 2011-09-28. اطلع عليه بتاريخ 2008-08-29.
- ^ "Etravirine (TMC125, Intelence) granted accelerated approval in US". aidsmap. مؤرشف من الأصل في 2010-01-02. اطلع عليه بتاريخ 2008-01-24.
- ^ "Intelence prescribing information" (PDF). FDA. مؤرشف من الأصل (PDF) في 2018-07-29. اطلع عليه بتاريخ 2012-01-19.
- ^ "Etravine: Summary of product characteristics" (PDF). EMEA. ص. 5. مؤرشف من الأصل (PDF) في 2016-08-20. اطلع عليه بتاريخ 2011-07-13.
- ^ "FDA Medwatch Safety Information". مؤرشف من الأصل في 2017-01-18. اطلع عليه بتاريخ 2009-08-27.
- ^ Alfedi، Giulia؛ Luffarelli، Riccardo؛ Condò، Ivano؛ Pedini، Giorgia؛ Mannucci، Liliana؛ Massaro، Damiano S.؛ Benini، Monica؛ Toschi، Nicola؛ Alaimo، Giorgia (2019). "Drug repositioning screening identifies etravirine as a potential therapeutic for friedreich's ataxia". Movement Disorders. ج. 34 ع. 3: 323–334. DOI:10.1002/mds.27604. PMID:30624801.
روابط خارجية[عدل]
| إيترافيرني في المشاريع الشقيقة: | |
| |