ثنائي كلوريد ثنائي الكبريت
| ثنائي كلوريد ثنائي الكبريت | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
Disulfur dichloride |
|
| تسمية الاتحاد الدولي للكيمياء | |
Dichlorodisulfane |
|
| أسماء أخرى | |
Bis[chloridosulfur](S–S) Dimeric sulfenic chloride |
|
| المعرفات | |
| CAS | 10025-67-9 |
| بوب كيم | 24807 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | S2Cl2 |
| الكتلة المولية | 135.04 غ/مول |
| المظهر | سائل زيتي أصفر |
| الكثافة | 1.69 غ/سم3 |
| نقطة الانصهار | −80 °س |
| نقطة الغليان | 138 °س |
| الذوبانية في الماء | يتفاعل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
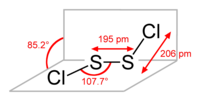
ثنائي كلوريد ثنائي الكبريت هو مركب كيميائي لاعضوي من الكلوريدات صيغته S2Cl2،[2][3][4][5] ويوجد في الشروط القياسية على شكل سائل زيتي له لون أصفر إلى بني.
التحضير[عدل]
يمكن أن يحضر هذا المركب من التفاعل المباشر بين العناصر المكونة له من الكلور والكبريت:[6]
يؤدي التفاعل مع كمية إضافية من الكلور إلى الحصول على ثنائي كلوريد الكبريت:
الخواص[عدل]
يوجد المركب في الشروط القياسية على شكل سائل زيتي له لون يتراوح بين الأصفر والبني، وله رائحة منفرة. يتحلل هذا المركب مع الماء بتفاعل حلمهة حيث يتشكل الكبريت وثنائي أكسيد الكبريت؛ في حين أن قابل للامتزاج مع مجموعة من المذيبات العضوية مثل الإيثانول والبنزين والكلوروفورم.[7]
الاستخدامات[عدل]
يستخدم المركب مادةً أولية في المختبرات الكيميائية للحصول على مركبات الكبريت العضوية.[8]
طالع أيضاً[عدل]
مراجع[عدل]
- ^ أ ب ت Disulfur dichloride (بالإنجليزية), QID:Q278487
- ^ Holleman, A. F.; Wiberg, E. Inorganic Chemistry Academic Press: San Diego, 2001. (ردمك 0-12-352651-5).
- ^ (1934)"Diphenylsulfide". Org. Synth.14: 36; Coll. Vol. 2: 242.
- ^ R. J. Cremlyn An Introduction to Organosulfur Chemistry John Wiley and Sons: Chichester (1996). (ردمك 0-471-95512-4)
- ^ Garcia-Valverde M., Torroba T. (2006). "Heterocyclic chemistry of sulfur chlorides – Fast ways to complex heterocycles". European Journal of Organic Chemistry. ج. 4 ع. 4: 849–861. DOI:10.1002/ejoc.200500786.
- ^ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 371–372.
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, (ردمك 0-07-049439-8)
- ^ Schmidt, M.; Siebert, W. "Sulphur" Comprehensive Inorganic Chemistry Vol. 2, ed. Aubrey Trotman-Dickenson. 1973.
| ثنائي كلوريد ثنائي الكبريت في المشاريع الشقيقة: | |
| |