حمض الكربوران
| Carborane acids H[CXB11Y5Z6] | |
|---|---|
| المعرفات | |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل |
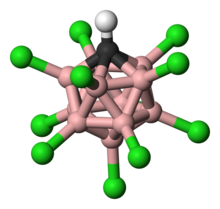
حمض الكربوران هو حمض فائق له الصيغة (H(CHB11Cl11 وهو من مركبات الكربورانات، والتي هي مركبات تجميعية عنقودية من الكربون والبورون والهيدروجين، بالإضافة إلى الكلور كما في حالة مركب حمض الكربوران.
الخصائص[عدل]
إن حمض الكربوران أقوى من حمض الكبريتيك بمليون مرة.[1] يعود سبب هذه الحموضة المرتفعة إلى أن أنيون الحمض، وهو الكربوران (−CHB11Cl11) يكون عالي الاستقرار، وبسبب وجود مستبدلات الكلور ذات الكهرسلبية العالية. كدليل على قوة هذا الحمض، فإنه الحمض الوحيد الذي يستطيع أن يبرتن الفوليرين C60 بدون أن يفككه.[2][3] بالإضافة إلى ذلك، فإن أنيون هذا الحمض، هو الأنيون الوحيد الذي يستطيع أن يشكل ملح مستقر قابل للعزل مع أيون الأرينيوم +C6H7.
الاستخدامات[عدل]
في الكيمياء التناسقية تستخدم الكربورانات كهياكل مميزة للربيطات ذات الحجم الكبير. وجد مؤخراً أن وحدة الكربورانيل يمكن ان تكون مستبدلات ساحبة للإلكترونات أو مانحة للإلكترونات وذلك حسب مكان ارتباط التجمع أو العنقود إلى الذرة غير المتجانسة.[4]
المراجع[عدل]
- ^ Olah, G. A.; Prakash, G. K. S.; Sommer, J.; Molnar, A. (2009). Superacid Chemistry (ط. 2nd). Wiley. ص. 41. مؤرشف من الأصل في 2022-06-28.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Juhasz, M.; Hoffmann, S.; Stoyanov, E.; Kim, K.-C.; Reed, C. A. (2004). "The Strongest Isolable Acid". Angewandte Chemie International Edition. ج. 43 ع. 40: 5352–5355. DOI:10.1002/anie.200460005. PMID:15468064.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Reed, C. A. (2005). "Carborane acids. New "strong yet gentle" acids for organic and inorganic chemistry" (PDF). Chemical Communications. ج. 2005 ع. 13: 1669–1677. DOI:10.1039/b415425h. PMID:15791295. مؤرشف من الأصل (pdf) في 2020-05-11.
- ^ Spokoyny, A. M.; Machan, C. W.; Clingerman, D. J.; Rosen, M. S.; Wiester, M. J.; Kennedy, R. D.; Stern, C. L.; Sarjeant, A. A.; Mirkin, C. A. (2011). "A coordination chemistry dichotomy for icosahedral carborane-based ligands". Nature Chemistry. ج. 3 ع. 8: 590–596. Bibcode:2011NatCh...3..590S. DOI:10.1038/nchem.1088. PMID:21778977.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)

![Ball-and-stick model of [CHB11Cl11]−. (Acidic proton not displayed). Colour scheme: هيدروجين − white, كلور − green, بورون − pink, كربون − black.](http://upload.wikimedia.org/wikipedia/commons/thumb/7/76/Carborane-acid-3D-balls.png/200px-Carborane-acid-3D-balls.png)