مستخدم:FkhrBuk/ملعب
| فقر الدم الخبيث | |
|---|---|
| معلومات عامة | |
| الاختصاص | علم الدم |
| تعديل مصدري - تعديل | |
فقر الدم الخبيث أو فقر الدم الوبيل (بالانجليزية: Pernicious anemia ) أحد أنواع فقر الدم ضخم الأرومات. أحد الأسباب الّتي قد تؤدي إليه فقدان في خلايا المعدة الجدارية، المسؤولة جزئيّاً عن إفراز العامل الداخلي ، الّذي هو عبارة عن بروتين ضروري في عملية الامتصاص اللاحقة لفيتامين ب12 في جزء اللفائفي من الأمعاء الدقيقة.
تدمير المناعة للخلايا الجدارية في المعدة (و تثبيط العامل الداخلي من قبل أجسام مضادة تستهدف مكونات لنفس جسم الإنسان ) الذي عادة ما يحدث في التهاب المعدة الضموري يؤدي إلى نقص العامل الداخلي[1]. بما أن امتصاص الأمعاء لكميات غذائية طبيعية للفيتامين ب12 يعتمد على العامل الداخلي فإن فقدان العامل الداخلي يؤدي إلى نقص فيتامين[2]ب12. في حين أن مصطلح 'فقر الدم الخبيث "في بعض الأحيان يستخدم أيضا بشكل غير صحيح للإشارة إلى فقر الدم الضخم الأرومات لأي سبب من نقص فيتامين ب 12 ،فإن الاستخدام الصحيح ينحصر في نقص فيتامين ب12 ناتج من أحد الأسباب التالية فقط : التهاب المعدة الضموري، وفقدان الخلايا الجدارية، وعدم وجود عامل داخلي. فقدان القدرة على امتصاص فيتامين ب 12 هو هو السبب الأكثر شيوعا لنقص ب12 عند كبار السن [3] ، والذي قد ينتج من فقدان العامل الداخلي أو إلى عدد من العوامل الأخرى التي تقلل إنتاج حامض المعدة الذي يلعب أيضا دورا في امتصاص ب12 من الطعام. تاريخيا، كان الكشف عن فقر الدم الخبيث لا يتم إلا بعد أن يسبب أعراضاً ويكون فقر الدم حينها تم بشكل مؤكد، أي أن مخزون الكبد من ب12 يكون قد استنفذ .الجانب "الخبيث" من المرض - قبل اكتشاف العلاج – كان توقعات سير المرض قاتلة، على غرار سرطان الدم في ذلك الوقت. ومع ذلك، منذ أن توضح سبب هذا المرض، فإن الاختبارات الحديثة التي تستهدف على وجه التحديد امتصاص ب12 يمكن أن تستخدم لتشخيص المرض قبل أن يصبح واضحا.إن استبدال مخازن الفيتامين لا يصحح الخلل في الامتصاص الناتج من فقدان العامل الداخلي. بما أن تعريف فقر الدم الخبيث هذا يتضمن الخلل في الامتصاص الناتج من فقدان العامل الداخلي فإن الناس من دون القدرة على امتصاص ب12 بهذه الطريقة سيكون لديهم فقر الدم الخبيث للفترة المتبقية من حياتهم . ومع ذلك، إذا لم يكن المريض قد أصيب بتلف دائم للأعصاب الطرفية قبل العلاج، فإن الاستبدال المنتظم لفيتامين ب12 سيحافظ على فقر الدم الخبيث مضبوطاً، مع عدم وجود فقر الدم وأي أعراض أخرى. على الرغم من أن العلاج الأولي للمرض عادة ما يتضمن حقن ب12 ليحل محل مخازن الجسم بشكل سريع، الا أن عدد من الدراسات أظهرت أن علاج استبدال على المدى الطويل للفيتامين يمكن أن يتم المحافظة على استمراريته مع جرعة عالية من مكملات وملحقات ب12 عن طريق الفم، حيث أن كمية كافية من ب12 يتم امتصاصها من هذه المكملات من قبل الأمعاء الطبيعية، حتى من دون أي عامل داخلي.في هذا الصدد لم يتم العثور على أشكال ب12 يتم تناولها من الأنف وتحت اللسان ويكون لها أي قيمة خاصة على أقراص البلع البسيطة.[4]
العلامات والأعراض[عدل]
تظهر حالة فقر الدم هذه على نحو غادر، أي أنها تسبب الأذى ببطئ ومهارة ، والعديد من العلامات والأعراض هي نتيجة لفقر الدم نفسه حيث يكون فقر الدم موجودا. فقر الدم الخبيث غير المعالج يمكن أن يؤدي إلى مضاعفات عصبية، وفي الحالات الخطيرة، الموت. ولكن في 20٪ من حالات نقص كوبالامين، لم يلاحظ وجود فقر الدم.[5] ثلاثي الأعراض : التنميل و تقرح اللسان و الضعف قد يتواجد في هذا المرض ، الا انهم ليسوا الأعراض الأساسية [6]. من الأعراض الشائعة فقر الدم[7] والتعب[7] والاكتئاب[8] والحمى[9] (من الدرجات المنخفضة) ، غثيان[10] ، أعراض الجهاز الهضمي (حرقة المعدة[11] ، إسهال[12] ، عسر هضم[13]) ، فقدان وزن[14] ،ألم أعصاب ، يرقان ، التهاب في اللسان[15] (احمرار ، نفخ ومظهر أملس) ، تقرحات في زوايا الفم[16] ) شفاه متشققة شاحبة وجافة[17] ، دوائر داكنة حول العينين (نظرات ارهاق) ، أظافر متشققة[18] ،أما الشعر[19] فيخف ويصبح رمادي في وقت مبكر. لأنها قد تؤثر على الجهاز العصبي، يمكن أن تشمل الأعراض أيضا صعوبة في استقبال الحس العميق[20](وهو شعور أو إدراك، وعادة في مستوى اللاوعي، من الحركات وضعية الجسم وخاصة أطرافه، بغض النظر عن رؤية.)، وتغييرات في الذاكرة[21]،ضعف معتدل في الادراك (بما في ذلك صعوبة التركيز والاستجابة البطيئة، ويشار بالعامية باسم ضباب الدماغ)، اضطراب عقلي، وضعف التبول[22]، وفقدان الإحساس في القدمين، مشية غير مستقرة[23]، وصعوبة في المشي[24]، وضعف[25] وارتباك[26] العضلات والحماقة . قد يسبب فقر الدم عدم انتظام دقات القلب (سرعة ضربات القلب[27] ولغط القلب، جنبا إلى جنب مع شحوب[28] بلون شمعي اصفر، انخفاض ضغط الدم، وارتفاع ضغط الدم، وضيق في التنفس[29] (المعروف باسم "تنهدات"). فقر الدم هذا أيضا قد يصاحبه اضطرابات الغدة الدرقية وفي الحالات الشديدة[30]، قد يسبب فقر الدم دليل على قصور القلب الاحتقاني[31] . ومن المضاعفات المزمنة الشديدة هي انحلال الحبل الشوكي تحت الحاد ، الأمر الذي يؤدي إلى فقدان الحس البعيد(العمود الخلفي)، غياب رد الفعل في الكاحل، وزيادة الاستجابة المنعكسة في الركبة، واستجابة[32] العضلات الباسطة الأخمصية. بالاضافة الى فقر الدم، يمكن أن تشمل الأعراض الدموية فقر في مكونات معينة من خلايا الدم، انحلال الدم داخل النخاع ، اعتلال الأوعية الدقيقة التخثري الكاذب[33] . فقر الدم الوبيل يمكن أن يسهم في تأخير في النمو البدني لدى الأطفال، ويمكن أيضا أن يكون سببا للتأخير في سن البلوغ بالنسبة للمراهقين.
الأسباب[عدل]
فيتامين ب12 لا يمكن إنتاجه في جسم الإنسان، ويجب الحصول عليها من الغذاء. عندما تؤكل الأطعمة التي تحتوي على ب12 يرتبط عادة الفيتامين ببروتين ويتم تحريره بواسطة حمض المعدة .بعد تحريره ، معظم ب12 يتم امتصاصه في الأمعاء الدقيقة (اللفائفي) بعد الربط مع بروتين يعرف باسم العامل الداخلي. ويتم إنتاج العامل الداخلي بواسطة الخلايا الجدارية لللغشاء المخاطي في المعدة (جدار المعدة) ومركب العامل الداخلي-ب12 يتم امتصاصه من قبل مستقبلات كيوبيلين الموجودة على الخلايا الظهارية للأمعاء الدقيقة اللفائفية [34][35]. فقر الدم هذا يتميز بنقص ب12 الناجم عن غياب العامل الداخلي.[36]
يمكن اعتبار هذا الفقر المرحلة النهائيةلالتهاب المعدة المناعي، وهو مرض يتميز ضمور المعدة ووجود الأجسام المضادة للخلايا الجدارية والعامل الداخلي[37] .وهناك شكل معين من التهاب المعدة المزمن، التهاب المعدة من النوع (أ)أو التهاب المعدة الضموري، يرتبط ارتباطا وثيقا بفقر الدم الوبيل. اضطراب المناعة الذاتية هذا يتمركز في جسم المعدة، حيث توجد الخلايا الجدارية[36]. الأجسام المضادة لخلايا العامل الداخلي والخلايا الجدارية تتسبب في تدمير الغشاء المخاطيالمفرز للحمض في المعدة، حيث توجد الخلايا الجدارية ، مما يؤدي إلى خسارة لاحقة فيبناءالعامل الجوهري(الداخلي). بدون العامل الجوهري، لا يتمكن الدقاق من امتصاص ال ب[38].12
على الرغم من أن دور عدوى البكتيريا الملوية البوابية في هذا المرض لا يزال مثيرا للجدل، تشير الأدلة إلى تورط البكتيريا الملوية البوابية في نشوء المرض. قد تسبب العدوى طويلة الأمد بالملوية البوابية المناعة الذاتية ضد المعدة من خلال آلية تعرف باسم المحاكاة الجزيئية. الأجسام المضادة التي ينتجها الجهاز المناعي يمكن أن تتفاعل بشكل متقاطعبحيث ترتبط بمستضدات الملوية البوابية وتلك الموجودة في الغشاء المخاطي في المعدة. ويتم إنتاج الأجسام المضادة من قبل خلايا ب المفعّلة تتعرف على كل من الممرض والببتيدات المستمدة من الذات. المستضدات الذاتية التي يعتقد أن تسبب تفاعلية ذاتية هي وحيدات ألفا وبيتا من H+/K+-ATPase.
أقل شيوعا، يمكن أن تسبب البكتيريا الملوية البوابية ومتلازمةزولينجر إليسون شكل من أشكال التهاب المعدة غير المناعي الذي يمكن أن يؤدي إلى فقر الدم الخبيث.
يمكن أن يحدث خلل في امتصاص ب12 أيضا بعد إزالة المعدة (استئصال المعدة) أو عملية مجازة معدية. في هذه العمليات الجراحية، يتم إزالة أجزاء من المعدة التي تنتج إفرازات المعدة أو يتم المرور عليها. وهذا يعني أن العامل جوهري، فضلا عن العوامل الأخرى اللازمة للامتصاص ب12، لا تتوفر. ومع ذلك، نقص ب12 بعد جراحة في المعدة لا يصبح عادة مشكلة سريرية. وربما هذا لأن مخازن الجسم من سنوات عديدة في الكبد تحتوي ب12 ويتم تزويد المرضى بعد جراحة المعدة بشكل كاف مع الفيتامين ب12. على الرغم من أنه لم يتم التعرف على أي جينات معينة تزيد من القابلية لفقر الدم الوبيل، على الأرجح أن هناك عامل وراثي متورط في هذا المرض. كثيرا ما وجد فقر الدم الخبيث بالتزامن مع اضطرابات المناعة الذاتية الأخرى، مما يوحي إلى أن جينات المناعة الذاتية المشتركة قد تكون عامل مسبب للمرض على الرغم من ذلك، فقد أشارت دراسات الأسرة السابقة وتقارير الحالة التي تركز على فقر الدم الوبيل أن هناك ميول للتوارث الجيني لهذا المرض على وجه الخصوص، وأقارب المرضى يبدو أن لديهم معدل أعلى لحدوث الاصابة بفقر الدم الوبيل وحالات مرتبطة بهذا المرض.[39][40][41]. وعلاوة على ذلك، أشير كذلك إلى أن تشكيل الأجسام المضادة لخلايا المعدة يحدد جينيا بشكل سائد، ووجود الأجسام المضادة للخلايا المعدة قد لا تكون ذات صلة بالضرورة إلى حدوث التهاب المعدة الضموري ذات الصلة بفقر الدم الوبيل.[39][41]
الفيسيولوجية المرضية[عدل]
على الرغم من أن مخازن الجسم ل ب12 بشكل طبيعي في الكبد تكفي 3 - 5 سنوات ، الا أن نشاط المناعة الذاتية التي لا يتم كشفها عادة في أمعاء المصاب على مدى فترة طويلة من الزمن يؤدي إلى نضوب ب12 وفقر الدم الناتج عنذلك. ب 12مطلوب من الانزيمات لتفاعلين؛ تحويل ميثل مالونل كو-ايه إلى سكسنل كو-إيه وتحويل هوموسيستيئين إلى ميثيونين.في التفاعل الأخير، يتم نقل مجموعة الميثيل من 5 ميثيل تتراهيدروفولات إلى هوموسيستيئين لإنتاج رباعي هيدروفولات وميثيونين. وتحفيز هذا التفاعل بواسطة انزيم ميثيونين سينسيز مع ب12 بمثابة العامل المساعد الأساسي. خلال نقص ب12، هذا التفاعل لا يمكن أن يتم ، الأمر الذي يؤدي إلى تراكم 5-ميثيل تتراهيدروفولات. هذا التراكم يستنفد أنواع أخرى من حمض الفوليك اللازمة لبناء بيورين و ثيميديليت،اللازمين من أجل بناء الحمض النووي. تثبيط تكاثر الحمض النووي في خلايا الدم الحمراء يؤدي إلى تكوّن كريات حمراءضخمة الأرومات الهشة و الكبيرة. ويعتقد أن الجوانب العصبية للمرض تنشأ من تراكم ميثل مالونل كو-ايه نظرا لمتطلبات ب12كعامل مساعد لانزيم ميثل مالونل كو-ايه ميوتيز..[34][42][43][44]
التشخيص[عدل]
الطبيعة الغادرة لفقر الدم الوبيل قد يعني أن التشخيص يتأخر. اختبار شيلينغ، الاختبار الكلاسيكي لفقر الدم الوبيل، لم يعد يستخدم على نطاق واسع، بما أن أساليب أكثر أمانا وأكثر كفاءة أصبحت متاحة. الجزء الأول من اختبار شيلينغ يتكون من أخذ جرعة فموية من ب12 المميز اشعاعياً، والحصول على النشاط الإشعاعي للبول بعد قياس على مدى فترة 24 ساعة. الجزء الثاني من الاختبار هو تكرار لأول مرة، مع إضافة العامل الجوهري عن طريق الفم. مع كمياتأقل من الطبيعية من العامل الجوهري المنتجة في فقر الدم الوبيل، إضافة عامل جوهري في الاختبار الثاني يسمح للجسم لامتصاص كميات أكثر من ب12، منتجاً ارتفاع النشاط الإشعاعي للبول. هذا الاختبار يمكن أن يميز فقر الدم الوبيل عن غيره من أشكال النقص في ب12. على وجه التحديد، اختبار شيلينغ يمكن استخدامهلتمييز فقر الدم الوبيل عن متلازمة إميرسلند-جريسبيك ، الذي هو أيضا مرض نقص فيتامين ب12 لكن الناجم عن الطفرات الوراثية في مستقبلات كوبالامين.[45] فقر الدم الوبيل قد يُشتبه به عندما تُظهر مسحة دم المريض كريات دم حمراء هشة، غير ناضجة كبيرة، والمعروفة باسم الأرومات الضخمة . تشخيص لفقر الدم الوبيل يتطلب أولاًإظهار فقر الدم الضخم الأرومات عن طريق إجراء تعداد الدم ومسحة الدم، الذي يقيم متوسطالحجم الكريوي ، فضلا عن متوسط تركيز هيموغلوبين الكرية. فقر الدم الوبيل يتصف بارتفاع متوسط الحجم الكريوي(فقر دم كبير الكريات)،ووجود متوسط تركيز هيموغلوبين الكرية ضمن الحدود الطبيعية (فقر دم سوي الصباغ)[46]. أيضاً الخلايا البيضاوية لخلايا الدم الحمراء تشاهد على مسحات الدم ، كما أن العدِلات المجزأة بإفراط من الصفات المعرفة على فقر الدم الضخم الأرومات (الذي يتضمن فقر الدم الوبيل و غيره). وتستخدم مستويات ب12 في مصل الدم للكشف عن نقص ب12، لكنها لا تميز أسبابه. يمكن لمستويات ب12 أن تكون بشكل خاطئ مرتفعة أو منخفضة والبيانات للحساسية والخصوصية تختلف على نطاق واسع. ويمكن الحصول على مستويات مصل طبيعية في حالات نقص ب12 ، حيث تتواجد اضطرابات التكاثر النقوي النخاعي، وأمراض الكبد، ونقص ترانزكوبالامين 2، أو زيادة نمو البكتريا المعوية. قد يكون سبب انخفاض مستويات المصل ب12 بسبب عوامل أخرى غير نقصب12، مثل نقص حمض الفوليك، والحمل، واستخدام وسائل منع الحمل عن طريق الفم، ونقصهابتوكوررين، والورم النخاعي.[47][48]
وجود أجسام مضادة للخلايا الجدارية في المعدة والعامل الجوهري أمر شائع في فقر الدم الوبيل. تم العثور على أجسام مضادة للخلايا الجدارية في اضطرابات المناعة الذاتية الأخرى، وأيضا في ما يصل إلى 10٪ من الأفراد الأصحاء، مما يجعل من الاختبارقليل التحديد. مع ذلك، حوالي 85٪ من المرضى فقر الدم الوبيل لديهم الأجسام المضادة الخلايا الجدارية، وهو ما يعني أنها علامة حساسة للمرض. الأجسام المضادة للعامل الجوهري أقل حساسية بكثير من الأجسام المضادة الخلايا الجدارية، لكنها أكثر تحديدا بكثير. وهي توجد في حوالي نصف المرضى، ونادرا جدا ما وجدت في اضطرابات أخرى. هذه الاختبارات للأجسام المضادة يمكن أن تميز بين فقر الدم الوبيل وسوء الامتصاص ل ب12 الموجود في الطعام.[48] وقد اقترح أن الجمع بين كل من اختبارات الأجسام المضادة للعامل الجوهري والأجسام المضادة للخلايا الجدارية يمكن أن تحسن الحساسية والخصوصية من نتائج التشخيص بشكل كامل.[49] إن تراكم بعض نواتج الأيض يحدث في نقص ب12 بسبب دورها في الفيسيولوجيا الخلوية. ويمكن قياس حمض الميثيل مالونيك في كل من الدم والبول، بينما يتم قياس الحمض الاميني هوموسيستيئين فقط في الدم. زيادة في كل من حمض الميثيل مالونيك والحمض الاميني يمكن أن تميز بين نقص ب12 ونقص حمض الفوليك لأن الحمض الاميني هوموسيستيئين يزيد فقط في الأخير.[48][50]
مستويات مرتفعة من الغاسترين يمكن العثور عليها في حوالي 80-90٪ من الحالات فقر الدم الوبيل، ولكنها يمكن أيضا أن تكون موجودة في الأشكال الأخرى من التهاب المعدة. انخفاض مستويات مولد الببسين 1 أوانخفاض نسبة مولد الببسين 1 إلى نسبة مولد الببسين2 قد تتواجد أيضاً ، على الرغم من أن هذه النتائج أقل تحديداً لفقر الدم الوبيل ويمكن العثور عليها في سوء امتصاص المواد الغذائية ل ب12 وغيرها من أشكال التهاب المعدة. وينبغي تأكيد تشخيص التهاب المعدة الضموري نوع أ من خلال تنظير المعدة وخزعة متدرجة .[51]حوالي 90٪ من الأشخاص الذين يعانون فقر الدم الوبيل لديهم أجسام مضادة للخلايا الجدارية. ومع ذلك، 50٪ فقط من جميع الأفراد في عامة السكان مع هذه الأجسام المضادة لديهم فقر الدم الخبيث.[52] يجب النظر في أشكال أخرى غير فقر الدم الوبيل من نقص ب12 في التشخيص التفريقي لفقر الدم الضخم الأرومات. على سبيل المثال، حالة نقص ب12 التي تسبب فقر الدم الضخم الأرومات قد يكون مخطئا باعتقادها فقر دم وبيل قد تكون ناجمة عن عدوى مع الشريطية العوساء العريضة ، وربما يعود ذلك إلى أن الطفيلي ينافس على ب12.[53]

العلاج[عدل]
علاج فقر الدم الوبيل يختلف من بلد إلى آخر ومن منطقة إلى أخرى. على وجه التحديد، هناك آراء غير متناسقة في فعالية الاعطاء (بالحقن / عن طريق الفم)، والكمية والفترة الزمنية للجرعات، أو أشكال فيتامين (على سبيل المثال سيانوكوبالامين /هيدروكوبالامين). لا تزال هناك حاجة دراسات أكثر شمولا من أجل التحقق من صحة جدوى أسلوب علاجي خاص للممارسات السريرية. لا يوجد علاج دائم لهذا الفقر ، على الرغم من أناشباع ب12 يُتوقَع منه أن يؤدي إلى وقف الأعراض المرتبطة بفقر الدم، وتوقف في تدهور الجهاز العصبي، و (في الحالات التي تكون فيها مشاكل عصبية ليست متقدمة) استرداد عصبي وتحسن كامل ودائم لجميع الأعراض، طالما أن ب12 يُزوَد. اشباع ب12 يمكن أن يتحقق من خلال مجموعة متنوعة من الطرق.
الحقن في العضل[عدل]
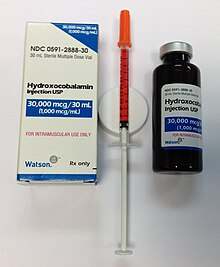
العلاج القياسي لفقر الدم الوبيل يكون حقنا في العضل (خارج الجهاز الهضمي) ،إعطاء كوبالامين في شكل سيانوكوبالامين وهيدروكسوبالامين. أندريس يوصي طريقة عامة للإعطاء في ثلاث مراحل؛ 1000 ميكروغرام / يوم لمدة 1 أسبوع، ثم 1000 ميكروغرام / الأسبوع لمدة 1 شهر، يليها 1000 ميكروغرام / الشهر مدى الحياة[54].
جرعات عن طريق الفم[عدل]
العلاج عن طريق الفم مع ارتفاع جرعة فيتامين ب12 يبدو فعالا أيضا.[54][55]
التنبؤ والتخمين بمسار المرض[عدل]
مريض فقر دم الوبيل المُعالج بشكل جيد يمكن أن يعيش حياة صحية. الفشل في التشخيص والعلاج في الوقت المناسب، قد يؤدي إلى تلف دائم للجهاز العصبي، والتعب المفرط، والاكتئاب، وفقدان الذاكرة، وغيرها من المضاعفات. فيالحالات الشديدة، يمكن أن المضاعفات العصبية من فقر الدم الخبيث يؤدي إلى الموت - ومن هنا جاءت تسميته، "الخبيث"، وهذا يعني قاتل.وقد لوحظ وجود ارتباط بين فقر الدم الخبيث وأنواع معينة من السرطان في المعدة، ولكن لم يثبت وجود علاقة سببية..[38]
علم الأوبئة[عدل]
يقدر أن يؤثر فقر الدم الوبيل على 0.1٪ من عموم السكان و 1.9٪ من الذين تزيد أعمارهم عن 60، وهو ما يمثل 20-50٪ من نقص ب12 في البالغين12. فقد تبين من مراجعة الأدب أن انتشار فقر الدم الوبيل كان أعلى في شمال أوروبا، وخاصة بالنسبة للدول الاسكندنافية والأصل الأفريقي، والتي فيها زيادة للوعي نحو المرض وأدوات أفضل للتشخيص قد تلعب دورا جزئيا في ذلك.[56]
التاريخ[عدل]
توماس أديسون طبيب بريطاني أول من وصف المرض في عام 1849، ولذلك سمي فقر الدم أديسون. في عام 1871، الطبيب الألماني مايكل انطون بيرمر (1827-1892) لاحظ المميزات الخاصة لفقر الدم في أحد مرضاه. صاغ في وقت لاحق مصطلح "فقر الدم الخبيث التدريجي". في عام [57]1907، أفاد ريتشارد كلارك كابوت على سلسلة من 1200 مريض. وكان متوسط البقاء على قيد الحياة بين سنة وثلاث سنوات. قام الدكتور ويليام بوسورث كاستل بتجربة حيث انه بلع لحم الهامبرجر الخام وتقيأه بعد ساعة، وبعد ذلك أطعمها لمجموعة من عشرة مرضى[58]. لحم الهامبرجر الخام غير المعالج كان يطعم لمجموعة التحكم. وأظهرت المجموعة الأولى استجابة للمرض، في حين أن المجموعة الأخيرة لم تظهر. لم يكن ذلك ممارسة مستدامة، ولكنها أثبتت وجود "عامل جوهري " من عصير المعدة. كان فقر الدم الخبيث مرضا قاتلا قبل حوالي عام 1920، عندما اقترح جورج ويبل الكبد النيء كعلاج. بدأت أول عملية لعلاج فقر الدم الخبيث عندما قام ويبل باكتشاف في سياق التجارب التي ترك الكلاب تنزف لجعلها تصاب بفقر الدم، ثم أطعمهم الأطعمة المختلفة لرؤية من من شأنها أن تجعلهم يتعافون أسرع (كان يبحث عن علاج للفقر الدم من النزيف، لا فقر الدم الخبيث). اكتشف يبل أن تناول كميات كبيرة من الكبد تعالج فقر الدم النانج من فقدان الدم، وحاول ابتلاع الكبد لعلاج فقر الدم الخبيث، فأبلغ تحسناً هناك، أيضا، في ورقة في عام 1920. جورج مينوت و وليم مورفي شرعوا لعزل الخاصية المعالجة في الكبد ، وعام 1926 أظهر أن الملكية العلاجية موجودة في عصير الكبد النيء (في عملية تبين أيضا أنه كان الحديد في أنسجة الكبد، وليس عامل قابل للذوبان في عصير الكبد، الذي شفى فقر الدم من النزيف في الكلاب، وبالتالي فإن اكتشاف عامل عصير الكبد لعلاج فقر الدم الخبيث كان عن طريق الصدفة). عملت فريدا بشكل وثيق مع ويبل، وشاركت في تأليف 21 ورقة 1925-30. لاكتشاف علاج لمرض كان سابقا قاتلا من سبب غير معروف، وتقاسم ويبل، مينوت، ومورفي على جائزة نوبل في الطب 1934.[59] بعد تحقق مينوت وميرفي من نتائج ويبل في عام 1926، أكل ضحايا فقر الدم الخبيث أو شربوا ما لا يقل عن نصف رطل من الكبد النيئة، أو شربوا عصير الكبد النيء، كل يوم. واستمر هذا لعدة سنوات، حتى أصبح عصير الكبد المركزمتاحاً. في عام 1928، أعد الكيميائي ادوين كوهن مستخلص الكبد الذي كان 50-100 مرة أكثر قوة من المواد الغذائية الطبيعية (الكبد). بل يمكن حقن المستخلص في العضلات، مما يعني المرضى لم تعد هناك حاجة لهم لتناول كميات كبيرة من الكبد أو العصير. هذا أيضا قلل من تكلفة العلاج إلى حد كبير. بقي العنصر النشط في الكبد غير معروف حتى عام 1948، عندما تم عزله من قبل اثنين من الكيميائيين، كارل من الولايات المتحدة وألكسندر تود من بريطانيا العظمى. كانت مادة الكوبالامين، التي سماها المكتشفون بفيتامين ب12.تمت تنقية الفيتامين الجديد في عصير الكبد تماما، ووصفه في 1950. ووضعت وسائل أخرى لإنتاجه من البكتيريا. يمكن حقنه في العضلات حتى مع تهيج أقل، مما يجعل من الممكن علاج فقر الدم الوبيلبسهولة أكثر. وقد عالجت فقر الدم الخبيث في نهاية المطاف إما الحقن أو جرعات فموية كبيرة عادة بين 1 و 4 ملغ يوميا.
الحالات البارزة[عدل]
- ألكسندر غراهام بيل - الاسكتلندي الكندي عالم ومخترع[60]
- ديفيد هيلبرت - عالم الرياضيات الألماني[61]
- سوفاس لاي - رياضيات النرويجية [62]
- غونار نوردستروم - الفيزياء النظرية الفنلندية (ربما نجم عن التعامل مع المواد المشعة والحمامات في الساونا الفنلندية حيث تم استخدام المياه التي تحتوي على مواد مشعة في الاعتقاد أنه صحي)
- آني أوكلي[63]
- تشونسي ألكوت - الملحن الأيرلندي للولايات المتحدة ومؤد
- نورمان وارن - محرر / الناشر وخطيبة بياتريكس بوتر[64]
- يون اون هاي - الممثلة الكورية الجنوبية [65]
البحث[عدل]
مركب snac[عدل]
على الرغم من أن جرعات كبيرة عن طريق الفم والحقن العضلي هي الأساليب الأكثر شيوعا من العلاج المتاحة حاليا، يجري اختبار عدة طرق جديدة، مع إمكانيات عالية لإدراجها في المستقبل في طرق العلاج السائدة. حيث أن الحقن طريقة غير مفضلة لإعطاء الأدوية، وتشمل البحوث الحالية تحسين الانتشار السلبي عبر الدقاق عند ابتلاع مشتقات كوبالامين عن طريق الفم. استفاد الباحثون مؤخرا من المركب الجديد : (sodium N-[8-(2-hydroxybenzoyl)amino]caprylate (SNAC مما يعزز إلى حد كبير على حد سواء التوافر البيولوجي والاستقرار الأيضي[66]،لأنه قادر على تشكيل رابطة غير تساهمية مع كوبالامين مع الحفاظ على السلامة الكيميائية[67]. هذا المركب أكثر حباً للدهون بكثير من ب12 الذائب في الماء، لذلك هو قادر على المرور عبر الأغشية الخلوية بسهولة أكبر.
العامل الجوهري المؤتلف[عدل]
طريقة أخرى لزيادة امتصاص من خلال الدقاق هي بلع مركب كوبالامين المرتبط بالعامل الجوهري. عدم وجود العامل الجوهري المنتج من جسم المريض يمكن أن يستعاض باستخدام عوامل جوهرية اصطناعية ينتج من نبات البازلاء المؤتلفة[68]. ومع ذلك، في الحالات التي تكون فيها الأجسام المضادة للعامل الجوهري هي السبب في سوء الامتصاص عبر الدقاق، فإن هذا العلاج غير فعال .
الإعطاء عن طريق تحت اللسان / الأنف[عدل]
افترض أن العلاج تحت اللسان أكثر فعالية من العلاجات عن طريق الفم وحده. ووجدت دراسة2003[69]، في حين أن هذه الطريقة فعالة، جرعة من500 ميكروغرام من سيانوكوبالامين تعطى إما عن طريق الفم أو تحت اللسان، انها فعالة على قدم المساواة في استعادة التركيزات الفسيولوجية الطبيعية للكوبالامين. كما درست طرق الأنف كوسيلة لإيصال كوبالامين. رصدت دراسة 1997[70]تركيز كوبالامين في البلازما من ستة مرضى الذين يعانون من فقر الدم الخبيث على مدى35يوم في حين يتم معالجتهم ب1500ميكروغرام من هيدروكسوبالامين عبر الأنف. ساعة واحدة بعد تناوله، أظهر جميع المرضى في المتوسط بزيادة ثمانية أضعاف فورية في تركيز كوبالامين البلازما وزيادة ضعفين بعد 35 يوم مع ثلاثة علاجات 1500ميكروغرام. ومع ذلك، هناك حاجة إلى مزيد من الدراسات لتحقيق فعالية على المدى الطويل من هذه الطريقة التسليم.
ملصقات عبر الجلد[عدل]
طريقة بديلة لعلاج فقر الدم الخبيث ويشمل استخدام ملصقات عبر الجلد. وتتكون هذه الملصقات من السيانيد-كوبالامين المرتبط مع مثبتات ب12، ومحسنات القدرة على اختراق البشرة[71]. ألياف النانو ال الكترون سبان - شحنة كهربائية لرسم دقيق جدا (عادة على مقياس صغيرة أو متناهية الصغر) ألياف من السائل - المحملة بالفيتامين قادرة على تقديم الفيتامين بطريقة فعالة من خلال الطبقة القرنية. الطريق عبر الجلد يسمح السيانيد-كوبالامين إلى الانتشار بشكل سلبي من خلال الطبقة القرنية، البشرة القابلة للحياة، وطبقة الأدمة، والدخول في النهاية في مجرى الدم.ألياف البولي كابرولاكتونالمحملة بالدواء 20 مغ 5% يمكن أن تطلق 340ميكروغرام من كوبالامين يوميا[72]. حيث انه يتم امتصاص الدواء مباشرة من البشرة إلى مجرى الدم، فإنه يتجنب اثر المرور الاول للكبد، ويحسن التوافر البيولوجي والكفاءة العلاجية للدواء. التحرير البطيء للدواء من الملصق إلى مجرى الدم يزيد أيضا من نصف العمر لها، والحفاظ على مستوى ثابت للسيانوكوبالامين في الدم لفترات أطول من الوقت. هذا يقلل من الجرعة المطلوبة بالمقارنة مع طرق الاعطاء عن طريق الفم..
المراجع[عدل]
- ^ "University of Chicago Med Ctr: Megaloblastic (Pernicious) Anemia". Retrieved 2008-01-27.
- ^ Kumar V (February 2007). "Pernicious anemia". MLO 39 (2): 28، 30–1. PMID 17375844.
- ^ Masnou H؛ Domènech E؛ Navarro-Llavat M؛ وآخرون (ديسمبر 2007). "Pernicious anaemia in triplets. A case report and literature review". Gastroenterología y Hepatología. ج. 30 ع. 10: 580–2. DOI:10.1157/13112591. PMID:18028852.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة)[وصلة مكسورة] - ^ "Office of Dietary Supplements". National Institutes of Health. اطلع عليه بتاريخ 2013-01-11.
- ^ Fred F. Ferri, M.D. "Ferri: Ferri's Clinical Advisor 2012, 1st ed". اطلع عليه بتاريخ 2015-12-26.
- ^ emedicine، Medscape. "Pernicious anemia Clinical Presentation". اطلع عليه بتاريخ 2013-01-21.
- ^ أ ب Ramani، James Carton, Richard Daly, Pramila (2007). Clinical pathology. Oxford: Oxford University Press. ISBN:0198569467.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Turgeon، Mary L. (2005). Clinical hematology : theory and procedures (ط. 4th). Philadelphia: Lippincott Williams & Wilkins. ISBN:0781750075.
- ^ emedicine، Medscape.Pernicious anemia Clinical Presentation
- ^ emedicine، Medscape. Pernicious anemia Clinical Presentation
- ^ emedicine، Medscape. Pernicious anemia Clinical Presentation
- ^ Turgeon، Mary L. (2005). Clinical hematology : theory and procedures (4th ed. ed.). Philadelphia: Lippincott Williams & Wilkins. ISBN 0-7817-5007-5.
- ^ Turgeon، Mary L. (2005). Clinical hematology : theory and procedures (4th ed. ed.). Philadelphia: Lippincott Williams & Wilkins. ISBN 0-7817-5007-5.
- ^ emedicine، Medscape. "Pernicious anemia Clinical Presentation". Retrieved 21 January 2013.
- ^ editors John P. Greer... [et (2009). Wintrobe's clinical hematology. (12th ed. ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. ISBN 0-7817-6507-2.
- ^ Turgeon، Mary L. (2005). Clinical hematology : theory and procedures (4th ed. ed.). Philadelphia: Lippincott Williams & Wilkins. ISBN 0-7817-5007-5.
- ^ Turgeon، Mary L. (2005). Clinical hematology : theory and procedures (4th ed. ed.). Philadelphia: Lippincott Williams & Wilkins. ISBN 0-7817-5007-5.
- ^ Turgeon، Mary L. (2005). Clinical hematology : theory and procedures (4th ed. ed.). Philadelphia: Lippincott Williams & Wilkins. ISBN 0-7817-5007-5.
- ^ editors John P. Greer... [et (2009). Wintrobe's clinical hematology. (12th ed. ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. ISBN 0-7817-6507-2.
- ^ Hvas AM،Nexo E (November 2006). "Diagnosis and treatment of vitamin B12 deficiency--an update.". Haematologica 91 (11): 1506–12. PMID 17043022.
- ^ Turgeon، Mary L. (2005). Clinical hematology : theory and procedures (4th ed. ed.). Philadelphia: Lippincott Williams & Wilkins. ISBN 0-7817-5007-5.
- ^ emedicine، Medscape. "Pernicious anemia Clinical Presentation". Retrieved 21 January 2013.
- ^ Hvas AM،Nexo E (November 2006). "Diagnosis and treatment of vitamin B12 deficiency--an update.". Haematologica 91 (11): 1506–12. PMID 17043022.
- ^ editors John P. Greer... [et (2009). Wintrobe's clinical hematology. (12th ed. ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. ISBN 0-7817-6507-2.
- ^ James Carton، Richard Daly،Pramila (2007). Clinical pathology. Oxford: Oxford University Press. ISBN 0-19-856946-7.
- ^ emedicine، Medscape. "Pernicious anemia Clinical Presentation". Retrieved 21 January 2013.
- ^ emedicine، Medscape. "Pernicious anemia Clinical Presentation". Retrieved 21 January 2013.
- ^ editors John P. Greer... [et (2009). Wintrobe's clinical hematology. (12th ed. ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. ISBN 0-7817-6507-2.
- ^ James Carton، Richard Daly،Pramila (2007). Clinical pathology. Oxford: Oxford University Press. ISBN 0-19-856946-7.
- ^ James Carton، Richard Daly،Pramila (2007). Clinical pathology. Oxford: Oxford University Press. ISBN 0-19-856946-7.
- ^ Turgeon، Mary L. (2005). Clinical hematology : theory and procedures (4th ed. ed.). Philadelphia: Lippincott Williams & Wilkins. ISBN 0-7817-5007-5.
- ^ "Pernicious anemia: MedlinePlus Medical Encyclopedia". Nlm.nih.gov. Retrieved 2010-03-18.
- ^ Andres E،Serraj K (2012). "Optimal management of pernicious anemia.". Journal of Blood Medicine 3: 97–103. doi:10.2147/JBM.S25620. PMC 3441227. PMID 23028239.
- ^ أ ب Wickramasinghe، SN (نوفمبر 2006). "Diagnosis of megaloblastic anaemias". Blood reviews. ج. 20 ع. 6: 299–318. DOI:10.1016/j.blre.2006.02.002. PMID:16716475.
- ^ Christensen EI, Birn H (أبريل 2002). "Megalin and cubilin: multifunctional endocytic receptors". Nat. Rev. Mol. Cell Biol. ج. 3 ع. 4: 256–66. DOI:10.1038/nrm778. PMID:11994745.
- ^ أ ب Banka S, Ryan K, Thomson W, Newman WG (يونيو 2011). "Pernicious anemia – genetic insights". Autoimmunity reviews. ج. 10 ع. 8: 455–9. DOI:10.1016/j.autrev.2011.01.009. PMID:21296191.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ De Block CE, De Leeuw IH, Van Gaal LF (فبراير 2008). "Autoimmune gastritis in type 1 diabetes: a clinically oriented review". The Journal of Clinical Endocrinology and Metabolism. ج. 93 ع. 2: 363–71. DOI:10.1210/jc.2007-2134. PMID:18029461.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Lahner E, Annibale B (نوفمبر 2009). "Pernicious anemia: New insights from a gastroenterological point of view". World J. Gastroenterol. ج. 15 ع. 41: 5121–8. DOI:10.3748/wjg.15.5121. PMC:2773890. PMID:19891010.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ أ ب Whttingham, S., Ungar, B., Mackay, I. R., & Mathews, J. D. (1969). The Genetic Factor in Pernicious Anemia. A Family Study in Patients with Gastritis. The Lancet, 1(7602), 951-954.
- ^ McIntyre, O. R., Sullivan, L. W., Jeffries, G. H., & Silver, R. H. (1965). Pernicious Anemia in Childhood. The New England Journal of Medicine, 272, 981-986.
- ^ أ ب Wangel, A. G., Callender, S. T., Spray, G. H., & Wright, R. (1968). A Family Study of Pernicious Anemia II. Intrinsic Factor Secretion, Vitamin B12 Absorption and Genetic Aspects of Gastric Autoimmunity. British Journal of Haematology, 14(2), 183-204.
- ^ Oh R, Brown DL (1 مارس 2003). "Vitamin B12 deficiency". American family physician. ج. 67 ع. 5: 979–86. PMID:12643357.
- ^ O'Leary F, Samman S (مارس 2010). "Vitamin B12 in health and disease". Nutrients. ج. 2 ع. 3: 299–316. DOI:10.3390/nu2030299. PMC:3257642. PMID:22254022.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Stover، PJ (يونيو 2004). "Physiology of folate and vitamin B12 in health and disease". Nutrition Reviews. ج. 62 ع. 6 Pt 2: S3-12, discussion S13. DOI:10.1111/j.1753-4887.2004.tb00070.x. PMID:15298442.
- ^ Andres, E., & Serra, K. (2012). Optimal management of pernicious anemia. Journal of Blood Medicine, 3, 97-103.
- ^ Pagana, Timothy James; Pagana, Kathleen Deska (2006). Mosby's manual of diagnostic and laboratory tests. Mosby Elsevier. ISBN:0-323-03903-0.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)[بحاجة لرقم الصفحة] - ^ Devalia V (أغسطس 2006). "Diagnosing vitamin B-12 deficiency on the basis of serum B-12 assay". BMJ. ج. 333 ع. 7564: 385–6. DOI:10.1136/bmj.333.7564.385. PMC:1550477. PMID:16916826.
- ^ أ ب ت Snow، CF (28 يونيو 1999). "Laboratory diagnosis of vitamin B12 and folate deficiency: a guide for the primary care physician". Archives of Internal Medicine. ج. 159 ع. 12: 1289–98. DOI:10.1001/archinte.159.12.1289. PMID:10386505.
- ^ Grasbeck, R. (2006). Imerslund-Grasbeck syndrome (selective vitamin B12 malabsorption with proteinuria). Orphanet Journal of Rare diseases, 1(1), 17.
- ^ Moridani، Majid؛ Shana Ben-Poorat (مارس 2006). "Laboratory Investigation of Vitamin B12 Deficiency". LabMedicine. ج. 37 ع. 3: 166–74. DOI:10.1309/cvhkle2r4w68k2nq.
- ^ Miederer, S.E. (1977). The Histotopography of the Gastric Mucosa. Thieme, ISBN 3-13-508601-1
- ^ Butler CC؛ Vidal-Alaball J؛ Cannings-John R؛ وآخرون (يونيو 2006). "Oral vitamin B12 versus intramuscular vitamin B12 for vitamin B12 deficiency: a systematic review of randomized controlled trials". Family Practice. ج. 23 ع. 3: 279–85. DOI:10.1093/fampra/cml008. PMID:16585128.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Ramakrishnan، edited by Usha (2000). Nutritional anemias. Boca Raton: CRC Press. ISBN:0849385695.
{{استشهاد بكتاب}}:|first=باسم عام (مساعدة) - ^ أ ب Andrès، E.؛ Fothergill، H.؛ Mecili، M. (2010). "Efficacy of oral cobalamin (vitamin B12) therapy". Expert Opinion on Pharmacotherapy. ج. 11 ع. 2: 249–256. DOI:10.1517/14656560903456053. PMID:20088746.
- ^ Andrès، E.؛ Dali-Youcef، N.؛ Vogel، T.؛ Serraj، K.؛ Zimmer، J. (2009). "Oral cobalamin (vitamin B12) treatment. An update". International Journal of Laboratory Hematology. ج. 31: 1. DOI:10.1111/j.1751-553X.2008.01115.x.
- ^ Stabler, S. P., & Allen, R. H. (2004). Vitamin B12 deficiency as a worldwide problem. Annual Review of Nutrition, 24(1), 299-326.
- ^ Whonamedit - dictionary of medical eponyms
- ^ William B. Castle 1897–1990 A Biographical Memoir by James H. Jandl Copyright 1995 National Academies Press Washington D.C.
- ^ Nobel Prize archive. "The Nobel Prize in Physiology or Medicine 1934" (Nobelprize.org). اطلع عليه بتاريخ 2012-08-05.
- ^ Gray، Charlotte. Reluctant Genius: Alexander Graham Bell and the Passion for Invention. New York: Arcade Publishing، 2006. ISBN 1-55970-809-3، page 418.
- ^ Geometry and Imagination. American Mathematical Society. Retrieved 2010-03-18.
- ^ "Sophus Lie". University of Tromso. Retrieved 2010-03-18.
- ^ <Please add first missing authors to populate metadata.>. Annie Oakley – MSN Encarta. Retrieved 2008-01-27.
- ^ "Noman Warne – The World of Beatrix Potter". Peter Rabbit. Retrieved 2010-03-18.
- ^ "Kbs Global". English.kbs.co.kr. 2009-10-28. Retrieved 2010-03-18.
- ^ Castelli، M. C.؛ Wong، D. F.؛ Friedman، K.؛ Riley، M. G. I. (2011). "Pharmacokinetics of Oral Cyanocobalamin Formulated with Sodium N-\8-(2-hydroxybenzoyl)amino]caprylate (SNAC): An Open-Label, Randomized, Single-Dose, Parallel-Group Study in Healthy Male Subjects". Clinical Therapeutics. ج. 33 ع. 7: 934–945. DOI:10.1016/j.clinthera.2011.05.088. PMID:21722960.
- ^ [1] تم أرشفته أكتوبر 6, 2014 بواسطة آلة واي باك
- ^ Fedosov، S. N.؛ Laursen، N. B.؛ Nexo، E.؛ Moestrup، S. K.؛ Petersen، T. E.؛ Jensen، E. O.؛ Berglund، L. (2003). "Human intrinsic factor expressed in the plant Arabidopsis thaliana". European Journal of Biochemistry. ج. 270 ع. 16: 3362–3367. DOI:10.1046/j.1432-1033.2003.03716.x. PMID:12899693.
- ^ Sharabi، A.؛ Cohen، E.؛ Sulkes، J.؛ Garty، M. (2003). "Replacement therapy for vitamin B12 deficiency: Comparison between the sublingual and oral route". British Journal of Clinical Pharmacology. ج. 56 ع. 6: 635–638. DOI:10.1046/j.1365-2125.2003.01907.x. PMC:1884303. PMID:14616423.
- ^ Slot WB, Merkus FW, Van Deventer SJ, Tytgat GN (أغسطس 1997). "Normalization of plasma vitamin B12 concentration by intranasal hydroxocobalamin in vitamin B12-deficient patients". Gastroenterology. ج. 113 ع. 2: 430–3. DOI:10.1053/gast.1997.v113.pm9247460. PMID:9247460.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Patent US20080233180 - Transdermal Patch and Method For Delivery Of Vitamin B12 - Google Patents
- ^ Madhaiyan، K.؛ Sridhar، R.؛ Sundarrajan، S.؛ Venugopal، J. R.؛ Ramakrishna، S. (2013). "Vitamin B12 loaded polycaprolactone nanofibers: A novel transdermal route for the water soluble energy supplement delivery". International Journal of Pharmaceutics. ج. 444 ع. 1–2: 70–76. DOI:10.1016/j.ijpharm.2013.01.040. PMID:23370432.

