إيزوفورون
| إيزوفورون[1] | |
|---|---|
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
3,5,5-Trimethylcyclohex-2-en-1-one |
|
| أسماء أخرى | |
Isophorone |
|
| المعرفات | |
| رقم التسجيل (CAS) | |
| CAS | 78-59-1[2] |
| بوب كيم | 6544[3] |
|
|
| الخواص | |
| الصيغة الجزيئية | C9H14O |
| الكتلة المولية | 138.21 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 0.925 غ/سم3 |
| نقطة الانصهار | −8.1 °س |
| نقطة الغليان | 215.32 °س |
| الذوبانية في الماء | 1.2 غ/100 مل ماء |
| المخاطر | |
| رمز الخطر وفق GHS |   |
| وصف الخطر وفق GHS | انتباه |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
إيزوفورون هو مركب عضوي حلقي كيتوني غير مشبع صيغته الكيميائية C9H14O؛ ويوجد على هيئة سائل عديم اللون.
الوفرة الطبيعية
[عدل]يوجد بشكل طبيعي في عدد من النباتات، مثل العنيبية الحامضة.[5]
التحضير
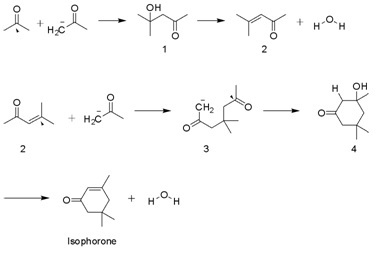
[عدل]يصطنع هذا المركب انطلاقاً من الأسيتون وفق تفاعل تكاثف ألدولي في وسط من هيدروكسيد البوتاسيوم. يتشكل أثناء التفاعل عدد من المركبات الوسيطية مثل كحول ثنائي الأسيتون وأكسيد الميسيتيل وكذلك 3-هيدروكسي-5،3،3-ثلاثي ميثيل حلقي الهكسانون. قد يتشكل بيتا-إيزوفورون ناتجاً ثانوياً عن التفاعل.[6]
الخواص
[عدل]يتبع إيزوفورون التفاعلات النمطية لكيتون ألفا وبيتا غير المشبع؛ ويؤدي تفاعل الهدرجة إلى الحصول على مشتقات حلقي الهكسانون. كما يخضع هذا المركب إلى تشكيل المشتق الأكسيدي عند التفاعل مع بيروكسيد الهيدروجين.[7] يتفكك هذا المركب بأثر جذور الهيدروكسيل الحرة.[8]
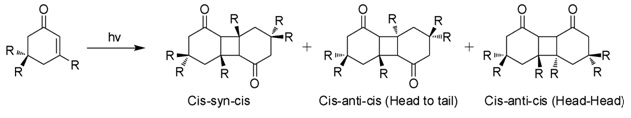
كما يخضع هذا المركب إلى تفاعل ديمرة ضوئية (Photodimerization) عند تعريض هذا المركب للضوء.[9]
الاستخدامات
[عدل]يستخدم هذا المركب على هيئة مذيب ومادة أولية في صناعة البوليمرات.[6]
طالع أيضاً
[عدل]المراجع
[عدل]- ^ Merck Index, 13th Edition, 5215.
- ^ isophorone، معهد المعلوماتية الحيوية الأوروبي، QID:Q902623
- ^ ا ب ج د ISOPHORONE (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ "Isophorone". مؤرشف من الأصل في 2024-09-13.
- ^ ا ب Hardo Siegel؛ Manfred Eggersdorfer (2005). "Ketones". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. DOI:10.1002/14356007.a15_077. ISBN:978-3-527-30673-2.
- ^ Richard L. Wasson؛ Herbert O. House (1957). "Isophorone Oxide". Org. Synth. ج. 37: 58. DOI:10.15227/orgsyn.037.0058.
- ^ "TOXNET". toxnet.nlm.nih.gov. مؤرشف من الأصل في 2017-10-24. اطلع عليه بتاريخ 2016-03-11.
- ^ Gonçalves, Huguette; Robinet, Germaine; Barthelat, Michèle; Lattes, Armand (28 Jan 1998). "Supramolecularity and Photodimerization of Isophorone: FTIR and Molecular Mechanics Studies". The Journal of Physical Chemistry A (بالإنجليزية). 102 (8): 1279–1287. Bibcode:1998JPCA..102.1279G. DOI:10.1021/jp9729270.

