بور البنزين
| بور البنزين | |
|---|---|
| الخواص | |
| الصيغة الجزيئية | C₅H₅B[1] |
| المعرفات | |
| CAS | 31029-61-5 |
| بوب كيم | 10899214[1] |
|
|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |

بور البنزين مركب عطري حلقي غير متجانس يتألف من حلقة بنزن حاوية على ذرة بورون بدلاً من ذرة كربون. على الرغم من بساطة تركيب المركب، ومن ثباتية الرابطة الكيميائية بين الكربون والبورون، فإنه لم يتم الحصول على الشكل الحر من هذا المركب، أي دون وجود ربيطة مانحة للإلكترونات، حيث يحصل عادة عليه بارتباط ربيطات مثل البيريدين أو ثلاثي فينيل الفسفين مع ذرة البورون. تسمى معقدات بور البنزين مع الربيطات الأنيونية مركبات بورات البنزين.
الخواص
[عدل]- تعود عدم ثباتية المركب في الشكل الحر إلى حموضة لويس المرتفعة لذرة البورون بسبب النقص الإلكتروني. باءت جميع المحاولات بالفشل من أجل عزل الشكل الحر، وأفضت جميعها إلى تشكيل معقدات مع ربيطات أنيونية أو معتدلة، لدرجة أنه حتى نيتروجين الهواء الجوي يرتبط معه.[2][3][4][5]
- في حال كونه كربيطة فإن بورات البنزين يحمل شحنة كهربائية سالبة على الحلقة السداسية، ويكون مانح قوي لإلكترونات π، مثل حلقي البنتادينيل، ولا ينتهي التشابه هنا، إذ كما يقوم حلقي البنتادينيل بتشكيل معقدات ميتالوسين الشطيرية مع الفلزات الانتقالية، فإن بور البنزين قادر على تشكيل معقدات مماثلة. بالإضافة إلى أن معقد بور البنزين الشطيري مع الزركونيوم يماثل معقد الزركونوسين (معقد الزركونيوم مع حلقي البنتادينيل) في نشاطه التحفيزي لتفاعل بلمرة الإيثيلين.
التفاعلات
[عدل]يتفاعل بور البنزين مع الألكاينات الفقيرة بالإلكترونات حسب تفاعل ديلز-ألدر ليشكل مركبات حاوية على البورون تشبه مركبات باريلين Barrelene، تسمى بورباريلين كما في التفاعل أدناه:[6]
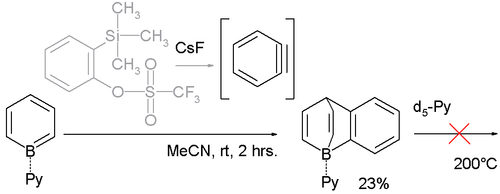
كما يتفاعل مع الأراينات Aryne، مثل البنزاين benzyne، والذي يحضر في مزيج التفاعل باستخدام 2-(ثلاثي ميثيل سيليل)فينيل تريفلات وفلوريد السيزيوم:
تكون قوة صفة حمض لويس للبورون في مركبات الباريلين تلك كبيرة، والذي يؤكد ذلك هو قصر طول الرابطة بين البورون والنيتروجين B-N، والتي تبلغ 158 بيكومتر، في حين أنها تبلغ 165 بيكومتر في نواتج إضافة النتروجين إلى ذرة البورون في المعقدات الأخرى. كما أن ذرة البورون لا تتخلى عن ربيطة البيريدين في معقدات البورباريلين، وذلك رغم استعمال البيريدين المديتر d5-Py عند درجة حرارة تصل إلى 200°س.
المراجع
[عدل]- ^ ا ب ج د ه Borin (بالإنجليزية), QID:Q278487
- ^ Allen, Christopher W.; Palmer, Donna E.; The Borabenzene Anion and Its Transition Metal Complexes؛ Journal of Chemical Education, 55, 8, 497-500, Aug 78 نسخة محفوظة 15 يونيو 2010 على موقع واي باك مشين.
- ^ André Languérand, et al.; [(IMes)2Pt(H)(ClBC5H4SiMe3)]: a Borabenzene-Platinum Adduct with an Unusual Pt-Cl-B Interaction؛ Angewandte Chemie International Edition; Volume 48 Issue 36, Pages 6695 - 6698; Published Online: 5 Aug 2009 - www3.interscience.wiley.com [وصلة مكسورة] نسخة محفوظة 2020-10-04 على موقع واي باك مشين.
- ^ Günther Maier, et al.; Nitrogen Fixation by Borabenzene؛ Angewandte Chemie; International Edition in English; Volume 27 Issue 2, Pages 295 - 296; Published Online: Dec 30 2003; DOI 10.1002/anie.198802951 [وصلة مكسورة] نسخة محفوظة 6 مارس 2020 على موقع واي باك مشين.
- ^ S. G. Semenov1 and Yu. F. Sigolaev; Borabenzene and pentafluoroborabenzene adducts with dinitrogen, xenon and krypton: A quantum-chemical study؛ Russian Journal of General Chemistry; Volume 76, Number 4 / April, 2006; DOI 10.1134/S1070363206040153 نسخة محفوظة 6 مارس 2020 على موقع واي باك مشين. [وصلة مكسورة]
- ^ 1-Borabarrelene Derivatives via Diels-Alder Additions to Borabenzenes Thomas K. Wood, Warren E. Piers, Brian A. Keay, and Masood Parvez, Org. Lett.; 2006; 8(13) pp 2875 - 2878; (Letter) دُوِي:10.1021/ol061201w