جهد اختزال

1 – قطب من البلاتين
2 – دخول غاز الهيدروجين
3 – محلول حمضي (H+ = 1 مول/لتر)
4 – مصيدة لمنع الأكسجين من الدخول
5 – خزان
جهد الاختزال في الكيمياء الكهربية لنظام كهركيميائي هو جهد اختزال أحد المواد مقاسا في الظروف القياسية بالمقارنة بنصف خلية قياسية. في الأنظمة الحيوية (البيولوجية) يعرف جهد الاختزال القياسي عند قيمة pH= 7,0 ويقاس بالمقارنة ب قطب قياسي للهيدروجين وضغط جزئي للهيدروجين قدره 1 ضغط جوي. (القيمة pH= 7,0 تسمى بالعربية أس هيدروجيني أو باهاء ، وعندما يكون «الأس الهيدروجيني» مساويا 7 يكون الماء نقيا متعادلا، أي لا حمضي، ولا قلوي).
مقـــدمة
[عدل]يمكن تقسيم تفاعل أكسدة-اختزال إلى نصفي تفاعل. في أحد نصفي التفاعل تحدث عملية أكسدة يحركها جهد أكسدة، وفي نصف التفاعل الآخر تجري عملية اختزال يحركها جهد اختزال. ويمكن وصف جهد الاختزال بأنه جهد أكسدة ولكن مع تغيير إشارته.
اختيار الظروف القياسية: الجهود القياسية
[عدل]
نظرا لاعتماد جهد الاختزال على ظروف الضغط ودرجة الحرارة أو قيمة باهاء pH ، فقد حددت حالة بعينها لإجراء المقارنة، وهي الظروف التي تعين تحتها أنصاف الأقطاب التي توجد في قائمة الجهود القياسية. في تلك الحالة تسود الظروف القياسية: يبلغ الضغط 1 ضغط جوي، ودرجة الحرارة 298,15 كلفن، وفاعلية كيميائية مساوية 1.
مثال:
تعتبر برمنجنات البوتاسيوم مادة مؤكسد شديدة، وتعتمد شدة أكسدتها وبالتالي جهدها المؤكسد بشدة على قيمة pH. وعندما نخلط برمنجنات البوتاسيوم بمادة اختزال، تنشأ كاتيونات المنجنيز -II عندما تكون قيمة pH = 1، أو ينشأ أكسيد المنغنيز الرباعي عندما يكون pH = 7، أو أيونات المنجنيز -(VI) عندما يكون pH = 14.
ويتم حساب جهد الاختزال لمادة عند أي ظروف مغايرة عن الظروف القياسية بواسطة معادلة نرنست.
طريقة القياس
[عدل]بالإضافة إلى ما ذكرناه بالنسبة إلى معادلة نرنست توجد عدة طرق لقياس جهد الاختزال عمليا:
يمكن قياس جهد الاختزال القياسي لنظام عن طريق الخلية الجلفانية الموضحة حيث يكون أحد الأقطاب هو القطب القياسي للهيدروجين وتعيين الجهد الكهربي بينه وبين القطب المراد قياسه. ويجب أن يكون نصفي الخلية في الظروف القياسية لدرجة الحرارة والضغط والتركيز.
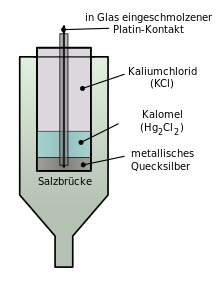
كما يمكن إجراء العملية باستخدام نصف خلية يكون جهد الاختزال لها معروفا واستخدامها للمعايرة. ولذلك نستخدم في مختبراتنا العملية أنصاف خلية أخرى كأنصاف خلية معايرة. ومن ضمنها قطب كالومل المشبع، حيث تقل باستخدامه نسبة الخطأ الناشيء عن تغير درجة الحرارة بالمقارنة باستخدام القطب القياسي للهيدروجين.
| درجة الحرارة | فرق الجهد |
|---|---|
| + 18 °C | + 0,2511 فولت |
| + 20 °C | + 0,2496 فولت |
| + 22 °C | + 0,2481 فولت |
ونستنتج من ذلك الجدول يتغير جهد الاختزال عندما تتغير درجة الحرارة درجتين بمقدار 6و0 % فقط.
جهد الاختزال القياسي
[عدل]يقاس جهد الاختزال القياسي () تحت الظروف القياسية:
- 25درجة مئوية، 1 مولية M تركيز كل نوع من الأيونات في التفاعل، ضغط جزئي =1 ضغط جوي لكل غاز مشترك في التفاعل، وتكون الفلزات في حالة نقية تماما.
ويعين جهد الاختزال القياسي بالمقارنة ب قطب قياسي للهيدروجين SHE كقطب مرجعي، حيث اصطلح العلماء على اتخاذ جهد القطب القياسي للهيروجين مساويا 00و0 فولت. ومن الوجهة التاريخية تستعمل بعض البلاد ومن ضمنها الولايات المتحدة وكندا [2]، جهد أكسدة قياسي عوضا عن جهد اختزال قياسي في حساباتهم. ولكن جهد الاختزال القياسي ما هو إلى جهد الأكسدة القياسي ولكن بإشارة مختلفة، فلا يشكل ذلك أي إشكال. وتنصح الهيئة الدولية للكيميائيين IUPAC التفرقة بين الاصطلاحين باستخدام symbols as == جهد اختزال و == «جهد أكسدة».
التحويل بين الأنواع المختلفة للأقطاب القياسية
[عدل]نجد في المجلات العلمية أحيانا قيم جهد الاختزال مقاسة بالنسبة إلى قطب عياري يختلف عن القطب المرجعي المراد. في تلك الحالة نلجأ إلى تحويل قيم جهد الاختزال إلى القيم المنتمية إلى القطب المرجعي المراد. كما يلزم أحيانا تحويل قياسات إلى جهد اختزال قياسي بغرض مقارنتها مع غيرها في منشورات علمية. ويمكن إجراء ذلك بسهولة بمعرفة أن الجهد المشاهد عمليا يمثل الفرق بين الجهد على القطب المستخدم والجهد على القطب المرجعي، أي أن:
حيث:
- التفاعل المشاهد،
- الجهد المرجعي المستخدم،
- الجهد المرغوب التحويل إليه.
العلاقات الفلطية بين الأنواع المختلفة للأقطاب القياسية عند درجة حرارة 25 °C :
حيث (SHE (mV : قطب قياسي للهيدروجين، (مللي فولت)
| القطب المرجعي | جهد القطب بالمقارنة ب (SHE (mV |
|---|---|
| قطب قياسي للهيدروجين (SHE) | 0 |
| قطب كالومل المشبع (SCE) | + 241 |
| Ag/AgCl, 1 M KCl | + 236 |
| Ag/AgCl, 4 M KCl | + 200 |
| Ag/AgCl, sat. KCl | +197 |
وعلى سبيل المثال، إذا قمنا بقياس القطب المشبع KCl Ag/AgCl كمرجع (ref2) وحصلنا على القيمة 300 مللي فولت وأردنا تعيينها بالنسبة إلى جهد الاختزال القياسي () المقاس باستخدام القطب القياسي للهيدروجين (ref1), عندئذ يجب «إضافة» 197 مللي فولت إلى 200 مللي فولت ونحصل على 497 مللي فولت، إذ أن:
وبالتالي نحصل على:
وبالتالي تكون:
وبالمثل، إذا قمنا بالقياس بواسطة قطب الفضة المشبع KCl Ag/AgCl (مرجعنا (ref2)) وعينا 300 مللي فولت وأردنا تحويله إلى المرجع قطب كالومل القياسي ref2) SCE) نحصل على:
وبالتالي تكون:
وبالتالي:
معادلة نرنست
[عدل]يعتمد الجهد على أس هيدروجيني لمحلول. وتكتب معادلة نصف تفاعل عادة كتفاعل اختزال، (حيث نكتب الإلكترون علي يسار المعادلة):
تمثل نصف الخلية جهد القطب القياسي ويعطى بالمعادلة:
حيث:
- التغير في طاقة غيبس الحرة القياسية،
- عدد الإلكترونات،
- و ثابت فاراداي.
وتربط معادلة نرنست بين الباهاء pH و:
حيث تدل الأقواس على الفاعلية الكيميائية لكل مادة كما هو معهود. وتبين المعادلة علاقة خطية لاعتماد على «الباهاء» pH حيث يبلغ الميل فولت (القيمة «باهاء» pH ليس لها وحدات.)
تعني هذه العلاقة أن الجهد ينخفض بزيادة الباهاء pH. ونشاهد ذلك عند اختزال الأكسجين O2 إلى OH− واختزال H+ إلى H2.
جهد الاختزال في البيولوجيا
[عدل]نحسب في العمليات البيولوجية الجهد ΔEo' عندما تكون pH 7. وفي التفاعلات المتعلقة بالبروتين نحصل على فرق جهد 0,413 فولت كما نرى في الجدول التالي:
- مع ملاحظة: عند اعطاء جهد الاختزال Eo أو Eo' في الجدول يكون الجهد مقاسا بالنسبة إلى القطب العادي للهيدروجين !. ويمكن الحصول على جهد اختزال أي تفاعل آخر ΔEo وبالتالي ΔEo' عن طريق حساب الفرق بينه وبين الجهد المعني Eo'.
| تفاعل أكسدة-اختزال | n | Eo in V by pH 0 | Eo' in V by pH 7 |
|---|---|---|---|
| Ferredoxin Fe2+/Fe3+ | 1 | −0,43 | −0,43 |
| ½ H2 /H+ | 1 | 0 | −0,413 |
| NADH,H + / NAD+, 2H+ | 2 | +0,09 | −0,32 |
| Liponsäure: Lipons.-H2/Lipons., 2 H+ | 2 | +0,21 | −0,20 |
| Ethanol/Acetaldehyd 2 H+ | 2 | +0,21 | −0,20 |
| Flavin-Nucleotide (FAD, FMN): F–H2/ F, 2H+ | 2 | +0,22 | −0,19*) |
| Glutathion: 2GSH/(GS)2, 2 H+ | 2 | +0,31 | −0,10 |
| Suc/Fum, 2 H+ | 2 | +0,38 | −0,03 |
| Ascorbat/Dehydroasc., 2 H+ | 2 | +0,35 | +0,06 |
| Hydrochinon/Ubichinon, 2 H+ | 2 | +0,51 | +0,10 |
| H2O/½O2, 2 H+ | 2 | +1,23 | +0,82 |
| Häm-Eisen-Proteine | |||
| Katalase Fe2+/Fe3+ | 1 | −0,5 | −0,5 |
| Peroxidase Fe2+/Fe3+ | 1 | −0,2 | −0,2 |
| Cytochrom b562 Fe2+/Fe3+ | 1 | −0,1 | −0,1 |
| Cytochrom b5 Fe2+/Fe3+ | 1 | +0 | +0 |
| هيموغلوبين، Myoglobin Fe2+/Fe3+ | 1 | +0,1 | +0,1**) |
| Cytochrom c Fe2+/Fe3+ | 1 | +0,25 | +0,25 |
- *) بالنسبة إلى Flavin-Nucleotiden فهو يكون مرتبطا بمجموعة بروستيتيك prosthetic group والتي يعتمد جهدها الاختزالي على زميل البروتين.
- **) من الظواهر العجيبة هي قلة استعداد الهيموجلوبين Hämoglobin لإعطاء إلكترون: وقد يؤدي ذلك إلى اختلال الأداء.
اقرأ أيضا
[عدل]- تفاعل أكسدة-اختزال
- جهد تحلل
- قطب كالومل المشبع
- تحليل كهربائي
- اختزال
- تفاعل عكوس
- بطارية الرصاص
- تفكك كيميائي
- كيمياء كهربية
- قائمة الجهود القياسية
المراجع
[عدل]- ^ Rolf Dolder: Stabilisation oxydationsempfindlicher Arzneistoffe als Redoxsysteme Dissertation Zürich 1950 نسخة محفوظة 26 مايو 2020 على موقع واي باك مشين.
- ^ How to teach the metric system to Americans - The Oatmeal نسخة محفوظة 04 أغسطس 2017 على موقع واي باك مشين.













![{\displaystyle aA+bB+n[e^{-}]+h[H^{+}]=cC+dD}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b7d9d81a980fe68ed80ddb673fd7db9835a4377)





