قوة الحمض
| أحماض وقواعد |
|---|
 |
| أنماط الحموض |
|
| أنماط القواعد |

الحمض القوي هو حمض يتأين (يتشرد) بشكل كامل في المحلول المائي (ليس في حالة حمض الكبريتيك لأنه حمض ثنائي الوظيفة)، أو بصيغة أخرى الحمض القوي هو الذي له ثابت تفكك الحمضpKa أقل من −1.[1] 74.
أغلب الأحماض الأكآلة تكون قوية، لكن ليس بالضرورة فحمض فلوريد الهيدروجين حمض ضعيف إلا أنه أكال.
معادلة التفكك الكامل لحمض في محلول مائي كالتالي:
- (HA)(aq) → H+(aq) + A−(aq)
تعريف
[عدل]إن تفكيك حمض قوي HA في الماء يتم على الشكل التالي (الرمز → يشير إلى أن التفاعل هو تام أو كلي، بينما التعبير aq يدل على أن العنصر الكيميائي مميه):
(HA)(aq) → H+(aq) + A−(aq)
الأيون A- هو قاعدة الحمض HA.
بالنسبة لحمض على غرار حمض الكبريتيك H₂SO₄، يمكن القول أنه حمض قوي، لا يحتاج إلا للذرة الأولى من الهيدروجين، وبالتالي :
H₂SO₄ (aq) → H+(aq) + HSO₄-(aq)
بينما تعتبر ذرة الهيدروجين الثانية من حمض الكبريتيك ضعيفة (الرمز ⇋ يدل على أن التفكيك جزئي)
HSO₄-(aq) ⇌ H+(aq) + SO₄²-(aq)
بطريقة أكثر دقة، يقال على أن الحمض هو ❞قوي❝ عندما تكون ال pKa (مرتبطة بالتابثة الحمضية الأخرى Ka عن طريق المعادلة pKa = -log10Ka) الخاصة به في المحلول المميه أصغر من نفسها في كاتيون الهيدرونيوم H₃O+ المتواجد طبيعيا في الماء، والذي له pKa = -1,7 هذا مع العلم أن أيونات الهيدرونيوم تعتبر أفضل مانحة للبروتونات بالنسبة للحمض المتواجد في جزء غير مفكك، مما يؤدي إلى نشوء حمض ضعيف. في حين عندما تكون جميع الجزيئات الحمضية مفككة، يتعلق الأمر هنا بحمض قوي.
استعمالات الأحماض القوية
[عدل]تستعمل الأحماض القوية عادة في:
- التحلل المائي
- تقدير الجرعات القاعدية والحمضية (الهدف طبي في العادة)
من بين مزايا الأحماض القوية أن كمية قليلة منها فقط كافية من أجل تحميض (جعله حامض) محلول ما. بل أنه في بعض الأحيان، تكفي قطرات قليلة جدا منه لهذا الغرض.
يتفكك الحمض القوي دائما من خلال تحرير كمية كبيرة من أيونات الهيدرونيوم مما يؤدي إلى تخفيف pH المحلول. حسب التعريف، فكلما كان المحلول مليئا بأيونات الهيدرونيوم كلما كان حمضيا أكثر.
يتمتع المحلول الحمضي بالعديد من الخصائص، لعل أبرزها أنه يستطيع كسر بعض الروابط الكيميائية، والتي تعود عليه في أحيان كثيرة بفائدة كبيرة.
يتفاعل الحمض القوي بسرعة كبيرة مع القاعدة القوية، حيث يكون التفاعل كلي مع تدفق خارجي للحرارة. بعض الأجهزة تستطيع تحديد الحمض القوي، مما يدل على أنها تستعمل وبكثرة في تقدير الجرعات كيف ما كان نوعها.
أمثلة لبعض الأحماض القوية
[عدل]من بين الأحماض القوية، نجد ما يلي:
- حمض الهيدروكلوريك، وهو محلول مميه لكلورور الهيدروجين HCl
- حمض الكبريتيك وصيغته الكيميائية H₂SO₄
- حمض النتريك وصيغته الكيميائية HNO₃
هذه الأحماض القوية تتفكك عادة في الماء، مع تحرير بعض الجزيئات الرئيسية على غرار HCl، HBr، HI، H₂SO₄ ... والتي بدورها تؤدي إلى تحرير الهيدرونيوم H₃O+ ومشتقات أيونية أخرى:
- حمض الهيدروكلوريك والذي يؤدي إلى إنتاج لكلورور الهيدروجين HCl عبر معادلة التفاعل التالية:
HCl(aq) + H₂O(aq) → H3O+(aq) + Cl-(aq)
- حمض البروميدريك والذي يحرر أيونات
Br- من خلال معادلة التفاعل التالية:
HBr(aq) + H₂O(aq) → H₃O+(aq) + Br-(aq)
- حمض الإيودريك والذي يحرر أيونات
I- وفق معادلة التفاعل التالية:
HI(aq) + H₂O(aq) → H₃O+(aq) + I-(aq)
الوقاية
[عدل]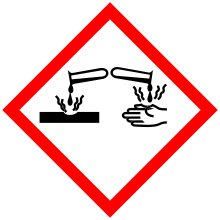
يجب التعامل مع الأحماض القوية بحذر، وذلك نظرا لخطورتها. إذ أن هناك قوانين للوقاية يتوجب احترامها عند استعمال مثل هذه المحاليل يدويا. ثم تصنيف خطورة هذه المواد من طرف نظام أوربي يعرف اختصارا ب SGH (قانون رقم 1272/2008) حيث:
- H314: تهيح شديد للبشرة على إثر الاحتراق، مما يؤدي إلى ضرر ذو علاقة بالعينين
- H318: تهيج يؤدي إلى إصابة خطيرة للعينين
معظم الأحماض القوية أكالة (تؤدي إلى حريق)، ولكن ليس دائما: الكربون هو حمض قوي مليون مرة مقارنة بحمض الكيبريتيك، على الرغم من ذلك إلا أنه غير أكَّال. في حين يعتبر حمض الكبريتيك أكال وخطير إلى درجة كبيرة، حيث أنه يسبب ضررا بالغا على مستوى العينين بالخصوص.
اقرأ أيضًا
[عدل]المصادر
[عدل]- ^ "معلومات عن حمض قوي على موقع zthiztegia.elhuyar.eus". zthiztegia.elhuyar.eus. مؤرشف من الأصل في 2019-12-18.
