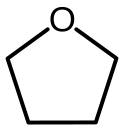
رباعي هيدرو الفوران
| رباعي هيدرو الفوران | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
أكسولان |
|
| أسماء أخرى | |
1،4 إيبوكسي بوتان |
|
| المعرفات | |
| رقم CAS | 109-99-9 |
| بوب كيم (PubChem) | 8028 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | C4H8O |
| الكتلة المولية | 72.11 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 0.89 غ/سم3 عند 20 °س |
| نقطة الانصهار | −108.4 °س |
| نقطة الغليان | 66 °س |
| الذوبانية في الماء | يمتزج مع الماء |
| الذوبانية | يمتزج مع الإيثانول والأسيتون وثنائي إيثيل الإيثر |
| البنية | |
| عزم جزيئي ثنائي القطب | 1.63 D |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| نقطة الوميض | - 20° س [4] |
| LD50 | 1650 مغ/كغ (جرذان، فموي) [5] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
رباعي هيدرو الفوران (يرمز له اختصاراً THF) مركب كيميائي له الصيغة C4H8O، وهو من المذيبات العضوية. يوجد المركب على شكل سائل عديم اللون في الشروط العادية من درجة الحرارة والضغط. ينتمي المركب إلى الإيثرات الحلقية.
الخصائص
[عدل]الفيزيائية
[عدل]رباعي هيدرو الفوران سائل عديم اللون، قابل للاشتعال، له رائحة تشبه الإيثر. يمتزج المركب مع الماء حتى درجة الحرارة 71.8 °س وذلك بشكل كامل، إلا أنه فوق تلك الدرجة تظهر بوادر عدم الامتزاج وذلك إلى الدرجة 137.1°س، حيث يعود الامتزاج إلى كماله.[6][7] يمتزج رباعي هيدرو الفوران مع باقي المذيبات العضوية مثل الإيثانول والأسيتون والإيثر الإيثيلي.
يشكل رباعي هيدرو الفوران عندما يكون محتواه من الماء 19.9 % مولي مزيجاً ثابت الغليان (أزيوتروبي) عند الدرجة 63.8°س.[8] أما مع الكحولات فإن المزائج ثابتة الغليان لا تحدث إلا مع الإيثانول والميثانول عند الضغط الجوي، [9] أما الكحولات ذات السلسة الكربونية الأطول مثل 1-بروبانول و2-بروبانول فهي ليست ثابتة الغليان.[9] في حين أنه عند ضغوط منخفضة فإن الإيثانول مثلاُ لا يظهر خاصية ثباتية الغليان مع رباعي هيدرو الفوران.[10]
الكيميائية
[عدل]كما يحدث مع الإيثرات فإن رباعي هيدرو الفوران يشكل مركبات فوق الأكاسيد عن طريق الأكسدة الذاتية جراء التعرض لأكسجين الهواء ومن أثر الأشعة فوق البنفسجية. لذلك ينصح قبل إجراء عملية تقطير المذيب حال استخدام رباعي هيدرو الفوران إجراء اختبار لمعرفة نسبة فوق الأكاسيد، كما ينصح بإضافة هيدروكسيد البوتاسيوم الصلب.
يؤدي تسخين رباعي هيدرو الفوران بوجود حمض الهيدروكلوريك إلى تفككه أولا إلى 4-كلور البوتانول ثم إلى 4،1-ثنائي كلور البوتان.[11]
التحضير
[عدل]إحدى طرق تحضير رباعي هيدرو الفوران تتضمن إجراء عملية بلمهة محفزة حمضياً لمركب 4،1-بوتانديول، وذلك بشكل مشابه لطريقة تحضير ثنائي إيثيل الإيثر من الإيثانول. يحصل على بوتانديول من إضافة كربوكسيل إلى الأسيتيلين ثم بإجراء عملية هدرجة. طورت شركة دو بونت طريقة لتحضير رباعي هيدرو الفوران من أكسدة نظامي البوتان إلى بلاماء الماليك متبوعاً بعملية هدرجة حفزية.[12] كما يمكن التحضير من إجراء تفاعل أوكسو للكحول الأليلي ثم بالهدرجة للبوتانديول.
بالمقابل يمكن تحضير رباعي هيدرو الفوران من هدرجة الفوران.[13][14] يمكن الحصول على الفوران من البنتوز، وهذ الطريقة يمكن أن تتضمن استخدام مصادر متجددة. على الرغم من ذلك فإن وسيلة التحضير هذه غير منتشرة على نطاق واسع.
الاستخدامات
[عدل]يستخدم رباعي هيدرو الفوران بشكل واسع في الصناعة كمذيب لبولي فينيل كلوريد وللورنيش.[15] يعد رباعي هيدرو الفوران من المذيبات اللابروتونية وقطبيته متوسطة، بحيث أنه يمكنه حل عدد كبير من المركبات الكيميائية القطبية واللاقطبية.[16] يستخدم رباعي هيدرو الفوران أيضاً كمذيب للمركبات العضوية الفلزية مثل مركبات الليثيوم العضوية وكواشف غرينيار.[17]
اقرأ أيضاً
[عدل]مراجع
[عدل]- ^ ا ب ج TETRAHYDROFURAN (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ صفحة البيانات الكيميائية من Alfa [وصلة مكسورة] نسخة محفوظة 2020-04-18 على موقع واي باك مشين.
- ^ صفحة البيانات الكيميائية من Merck نسخة محفوظة 29 مايو 2020 على موقع واي باك مشين.
- ^ Ullrich Jahn, in: Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ^ J. Matous, J. Hrancirik, J. P. Novak, J. Sobr: Liquid-liquid equilibrium in the system water-tetrahydrofuran, in: Coll. Czech. Chem. Commun. 1970, 35, 1904–1905.
- ^ J. Matous, J. P. Novak, J. Sobr, J. Pick: Liquid-liquid equilibrium in the system water-tetrahydrofuran (2), in: Coll. Czech. Chem. Commun 1972, 37, 2653–2663.
- ^ W. Hayduk, H. Laudie, O. H. Smith: Viscosity, freezing point, vapor-liquid equilibriums, and other properties of aqueous-tetrahydrofuran solutions, in: J. Chem. Eng. Data 1973 18 (4), 373–376; دُوِي:10.1021/je60059a027.
- ^ ا ب Yoshio Yoshikawa, Akira Takagi, Masahiro Kato: Indirect Determination of Vapor-Liquid Equilibria by a Small Ebulliometer. Tetrahydrofuran-Alcohol Binary Systems, in: J. Chem. Eng. Data 1980, 25 (4), 344–346; دُوِي:10.1021/je60087a017.
- ^ E. Brunner, A. G. R. Scholz: Isobaric vapor-liquid equilibria of the tetrahydrofuran/ethanol system at 25, 50, and 100 kPa, in: J. Chem. Eng. Data 1984, 29 (1), 28-31; دُوِي:10.1021/je00035a011.
- ^ Autorenkollektiv: Organikum, 22. Auflage, Wiley-VCH, 2004, ISBN 978-3-527-31148-4.
- ^ Merck Index of Chemicals and Drugs, 9th ed.
- ^ Morrison, Robert Thornton; Boyd, Robert Neilson: Organic Chemistry, 2nd ed., Allyn and Bacon 1972, p. 569
- ^ Donald Starr and R. M. Hixon(1943)."Tetrahydrofuran". Org. Synth.; Coll. Vol. 2: 566.
- ^ Herbert Müller, "Tetrahydrofuran" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. دُوِي:10.1002/14356007.a26_221
- ^ "Chemical Reactivity". Cem.msu.edu. مؤرشف من الأصل في 2010-04-18. اطلع عليه بتاريخ 2010-02-15.
- ^ Elschenbroich, C.; Salzer, A. ”Organometallics : A Concise Introduction” (2nd Ed) (1992) Wiley-VCH: Weinheim. ISBN 3-527-28165-7


