عائلة بي سي إل 2
بروتين بي سي إل-2، كان أول من تم اكتشافه لمكافحة موت الخلايا، وشكل هذا الاكتشاف علامة فارقة في أبحاث بيولوجية تخص الأورام. وقد تم تحديد عدة أعضاء بشرية تحتوي على بروتين بي سي إل-2 المنظم لموت الخلايا المبرمج. عائلة بروتينات بي سي إل-2 تنظم جميع الأنواع الرئيسية لموت الخلية، بما في ذلك موت الخلايا المبرمج، النخر والالتهام الذاتي، وبالتالي تعمل كنقاط عقدية عندالتقاء مسارات متعددة مع أهمية واسعة لعلاج الأورام.العلاجات التجريبية التي تستهدفها بروتينات عائلة بي سي إل-2 على الحمض النووي الريبورزي الناقل (حمض نووي ريبوزي رسول) أو بروتينات هي حالياً تحت الاختبار، مما زاد الامال بأن فئة جديدة من الأدوية المضادة للسرطان قد يكون متاحاً في وقت قريب.
بُنية بروتين بي سي إل-2
[عدل]
تتكون أفراد عائلة بي سي إل-2 من بنية ثلاثية الأبعاد تحتوي على مركزين اثنين، ولوالب ألفا الحلزونية ذو خاصية الكارهة للمياه يحيط بها ستة أو سبعة لوالب ألفا الحلزونية ذو الطبيعة الثنائية (أي تمتلك كلاهما خاصية المحب للمياه وخاصية الكاره للمياه) متفاوتة بالأطوال. حلقة طويلة غير منظمة موجودة بين اللولب الأول واللولب الثاني من لوالب ألفا الحلزونية. ترتيب لوالب ألفا الحلزونية يشبه الترتيب ل الخانوق (الدفيتريا) والمبيد الجرثومي (كوليسين). سُم الخانوق أو الدفيتريا تشكل مسام نقل غشائية وتنقل مجالات من السموم المحفزة في سيتوبلازم خلية حيوانية. الكوليسين مشابه لشكل الثغور الموجودة في طبقتي الدهون. أفراد عائلة بي سي إل تُقسم إلى فرعين اثنين على أساس وجود واحد أو أكثر من مناطق تماثل بي سي إل (بي إتش)[28] . وقد تم تحديد أربعة من هذه المناطق (بي إتش 1 – بي إتش 4) من تسلسل متماثل، ويحتوي كل فرد من أفراد عائلة بي سي إل 2 واحد منهم على الأقل. معظم الأفراد من الفئة الفرعية ما قبل البقاء، مثل بي سي إل -2، بي سي إل – إكس إل، بي سي إل – ث، والبروتين سي إي دي – 9 من سي ايليجانس، تمتلك المناطق الأربعة كلها (بي إتش). آخرون، مثل (إ م سي إل-1)، والبروتين (بي إتش آر إف 1) من فيروس ابشتاين بار، و (كي إس إتش في) - بي سي إل 2 من فيروس ساركوما كابوزي، تمتلك تسلسل متماثل قوي فقط في المناطق بي إتش 1، بي إتش2، وبي إتش3. نطاقات بي إتش 1، بي إتش 2، وبي إتش 3 تؤثر بشكل قوي على الاصطناع الثنائي المتماثل والغير متماثل من هذه البروتينات[29] .بروتينات ما قبل استماتة، يمتلك أفراد الفئة الفرعية باكس تسلسل متماثل للمناطق بي إتش 1، بي إتش2، وبي إتش3 بينما أفراد الفئة الفرعية بي إتش 3 يكون التماثل القوي فقط في المنطقة بي إتش 3. يمكن لأفراد عائلة ما قبل الـ استماتة التي تحتوي على مناطق بي إتش1 وبي إتش 2 مثل باكس وباك تعزيز الإستماتة من خلال تفاعلها مع أغشية المايتوكندريا. هذا النشاط المستقل من قدرتها على التفاعل مع بروتينات مضادة الإستماتة. منطقة بي إتش 3 مسؤولة عن التوسط خلال التفاعل مع بروتينات مضادة الإستماتة وقدرة البروتينات لتعزيز موت الخلية المُبرمج [30] . الببتيدات المستمدة من منطقة بي إتش 3 لأفراد ما قبل الإستماتة من عائلة ب سي إل يمكن أن تربط في أفراد عائلة مضادة الإستماتة مثل بي سي إل – إكس، وبي سي إل – 2 لتنظيم طرق الإستماتة في الخلايا الحية [31] وبالإضافة إلى مناطق البي إتش، فإن العديد من أفراد عائلة بي سي إل 2 تمتلك نطاقات كارهة للمياه في النهاية الكربوكسية، التي يتوقع أن تكون مسؤولة عن تمركٌز الغشاء [32][33]. أنماط تمركُز الغشاء تختلف بين بروتينات مضادة الـ استماتة وبروتينات ما قبل الـ استماتة. على سبيل المثال، فقد تبين بي سي-2 موجود على السطح السيتوبلازمي من الغشاء الخارجي للميتوكندريا. تم تحديد بنية بي سي إل (إكس إل) البشري بواسطة دراسة البلورات بالأشعة السينية والرنين المغناطيسي النووي [34]. جميع البروتينات مضادة ال استماتة تحتوي على نطاقات بي إتش 1 وبي إتش 2، وبعضها يحتوي على نطاق إضافي بي إتش 4 في النهاية الأمينية (بي سيل إل – 2، بي سي إل - إكس إل، بي سي إل - ث)، والتي تعتبر أيضاً في بعض البروتينات ما قبل الإستموات مثل (بي سي إل (إس)، ديفا (Diva)، بوك (إل)، وبوك (إس)). ثلاث وظائف مهمة لمناطق التماثل (بي إتش 1، بي إتش 2، بي إتش 3) وهي في القرب المكاني [35].
أسرة الخلايا البائية (بي سي ال -2)
[عدل]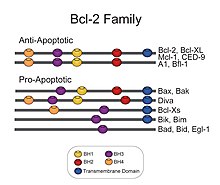
أسرة الخلايا البائية (بي سي ال-2): خلية لمفاوية ب-2, هي بروتينات لها ترميز في البشر بواسطة جينات بي سي إل 2 . [36]أسرة البروتينات المنظمة بي سي ال 2 المعروفة ببرنامج الحماية «البوابة الهامة» في الاستجابة، هذه المجموعة من البروتينات الهيكلية ذات الصلة تتألف من (مثيرات ما قبل الاستمواتوالأفراد المكافحة للايستموات) التي تتفاعل مع بعضها البعض.[37]ويقيم أفراد أسرة بي سي ال 2 في منبع الضرر الخلوي الذي لا رجعة فيه، وتركز جزء كبير من مجهودها على مستوى المايتوكندريا وتلعب دورا محوريا فيما إذا كانت الخلية ستعيش أو تموت فبالتالي تعمل كنقطة قرار حاسم في الحياة أو الموت داخل المسارالموحدالمبرمج.[38]
تسميتها بالخلية اللمفاوية: يتمتع الجسم بنوعين رئيسيين من الخلايا اللمفية التي يمكن أن تتطور إلى الأورام اللمفية: الخلايا الليمفاوية (الخلايا البائية) واللمفاويات (الخلايا التائية), وخلايا الاورام الليمفاوية البائية تنشأ من تطور غير طبيعي للخلايا البائية.
وظيفة بروتين بي سي إل-2
[عدل]بي سي إل 2 هو المعرب عنها في مجموعة متنوعة واسعة من الأنسجة الجنينية ولكن التعبير يبدو أن يقتصر على الخلايا التي يتم نموها وتمايزها بسرعه في خلايا الكبار. بينما بروتين بي سي إل 2 يكون في مستويات مرتفعة في معظم الخلايا العصبية للفأر النامي، يتناقص في العديد من المناطق في الجهاز العصبي المركزي (CNS) بعد الولادة ولكن يبقى مرتفعاً في الجهاز العصبي المحيطي [PNS) [39]. بينما في العصبون الحركي، بي سي إل 2 موجود بشكل واضح جداً خلال فترة الحمل والفترة ما بعد الولادة المبكرة. وكما درس أيضاً الخلايا في جهاز المناعة ومن بينها الخلايا اللمفاوية [40] وأيضاً بروتين بي سي إل 2 موجود بشكل منتشر في الخلايا ما قبل البائية (CD43+) والخلايا البائية الناضجة، ولكن يكون أقل تنظيماً في مرحلة الخلايا ما قبل البائية التي تحتوي على حشوة تحتوي على سلاسل (µ) تستعد للإبانة عن سطح (Ig)، ومن ثم التمايز إلى أن تنضج الخلايا البائية. [41] و يبدواأيضان بروتين البي سي ال 2 يلعب دوراً في الحفاظ على بقاء مستقبلات المستضدالمحدد لـ الخلايا البائية في العقد اللمفاوية. وهكذا، بالإضافة إلى السماح لمزيد من الخلايا البقاء على قيد الحياة وتدخل المحيط ناضجة، وتمتد فترات الحياة للخلايا البائية عن طريق هذا البروتين.[42] [43][44] مثلاً في الغدة الصعترية، تم العثور على بروتين بي سي إل 2 في جميع أنحاء النخاع الشوكي، ولكن فقط في عدد قليل من خلايا قشرة الدماغ. في هذه الخلايا يتم ضبط مستوى بروتين بي سي إل 2 في هذا النسيج بدقة ويوازي مراحل تمايز الخلايا التائية.[45] بروتين بي سي إل 2 موجود في السالبية المزدوجة (DN; CD4-CD8) في الخلايا التوتية (Thymocyte)، وتقلل من الايجابية المزدوجة (DP;CD4+CD8+) للخلايا ويزيد أيضاً من الايجابية المفردة للخلايا التائية. وهذا يتفق مع فكرة معالجة معلومات الخلايا التوتية، وهي الأكثر حساسية تجاه المنبهات مثل الديكساميثازون أو الشعاع من فئة جاما (γ)، وأن الافراط في بروتين بي سي إل 2 عن طريق التحوير على سبيل المثال، يحمي معالج معلومات الخلايا التوتية من الأذى. [46] السلبية الانتقائية، وهي السمة المميزة لـ الغدة الصعترية وأحد الاسباب الرئيسية لموت الخلايا وخاصة بالنسبة لـ الغدة الصعترية في معالجة المعلومات للخلايا التائية، ويمكن أن يعادى مع بروتين بي سي إل 2 بدرجة عالية [47][48][49]
أمثلة على عائلة بي سي إل-2
[عدل]البروتينات المعروفة باحتوائها على هذه الأنواع تشمل: بي سي إل-2 الموجود في الفقاريات (بأشكاله البروتينية المتعددة ألفا وبيتا) وبي سي إل- اكس (أشباهه بي سي إل- اكس (إل)) ومنها:
- بي سي إل 2 إل 1 , بي سي إل 2 إل 2, بي سي إل 2 إل10, بي سي إل 2 إل 14.
- بوك
- إم سي إل 2
بي سي إل 2 مثل بروتين 1 يكتب بي سي إل 2 إل 1 هو جين بشري. من خلال الربط البديل أو الربط التفاضلية (هو عملية منظمة خلال التعبير الجيني أي تحويل المادة الوراثية من خلال الترميز إلى جين واحد تتم ترجمته لـ البروتينات متعددة.)، يترجم إلى البروتينات البشرية بي سي إل -إكس إس وبي سي إل-إكس.
الوظيفة البروتينات التي تترجم من هذا الجين تندرج أو تنتمي إلى عائلة: بي سي إل 2. أعضاء هذه العائلة تتكون من جزيئات متماثلة أو مختلفة تعمل كمنظمات (إما ان تكون مضادات أو مواليات للموت المبرمج) التي تشارك في الأنشطة الخلوية بأشكال واسعة ومتعددة. توجد البروتينات المشفرة بواسطة هذا الجين في غشاء الميتوكوندريا الخارجي، وتبين أنها تنظم عمل (فتح) القناة (القنوات الأيونية التي تعتمد على الجهد) الموجودة في غشاء الميتوكوندريا الخارجي. القنوات الأيونية التي تعتمد على الجهد تنظم إمكانات غشاء الميتوكوندريا، وبالتالي يتحكم في إنتاج أنواع الأكسجين التفاعلية والإفراج عن (إخراج) السيتوكروم سي من الميتوكوندريا، وكلاهما من المحرضات القوية لموت الخلايا المبرمج (وهو عملية موت الخلية لغرض النمو والتطور). يمكن نسخ هذا الجين بطريقتين مختلفتين بحيث يرمز لإعطاء شكلين (الإسوي) مختلفين للبروتين، الشكل (الشبيه) الطويل: بي سي إل-إكس إل الذي يعمل كمثبط والشبيه القصير الذي: بي سي إل -إكس إس يعمل كمنشط. ال (لنك أر أن أيه) (شريط طويل غير مشفر من ال أر أن أيه، هو ال أر أن أيه الذي يعمل دون ان يشفر البروتين) تشارك من خلال الربط البديل بين الشبيهين: بي سي إل -إكس إس و: بي سي إل-إكس إل. هذا الشريط الغير مشفر يعمل في تحضير موت الخلية ويكون تحت التنظيم أو السيطرة في الخلايا السرطانية.
بي سي إل -2 مثل بروتين 2 هو بروتين في البشر يتم ترميز بواسطة جين ال بي سي إل 2 إل 2 اكتشفه يوني جيبسون، سوزان كوري وزملاؤهم في معهد والتر اليزا للأبحاث الطبية، الذي أطلق عليه اسم بي سي إل -دبليو. الوظيفة: هذا الجين يشفر عضوا البقاء على قيد الحياة (مكافحة الموت المبرمج) من عائلة بروتينات ال بي سي إل 2. البروتينات من هذه الأسرة يكونون مركبات من جزيئات متماثلة أو مركبات من جزيئات غير متماثلة ويكون بمثابة مكافحة أو موالي لمنظمات للموت المبرمج. وقد تبين ان هذا الجين في الخلايا يساهم في تقليل موت الخلايا المبرمج في ظل الظروف السامة للخلايا. وأشارت دراسات على هذا الجين في الفئران انه يلعب دورا في بقاء ال (إن جي إف)- و (بي دي إن أف) التي تعتمد عليها الخلايا العصبية. بينت الطفرات والدراسات العميقة لجين الفأر انه يسهم بدور أساسيا في تكوين الحيوانات المنوية الناضجة.بالنسبة لنظير ال بي سي إل 2. توجد بيانات اقل حول هذا البروتين. هو يقع على الكروموسوم 41 يبدو أنه يكون زائد عن الحاجة في معظم الأنسجة بصرف النظر عن أمثلة محددة.
: بي سي إل 2 مثل بروتين10 بروتين بشري يتم ترميزه بواسطة الجين بي سي إل2 إل 10 وهو من بروتينات عائلة بي سي إل 2 البروتينات من هذه الأسرة تكون مركبات من جزيئات متماثلة أو مركبات من جزيئات غير متماثلة ويكون بمثابة مكافحة أو موالي لمنظمات للموت المبرمج والذي يسهم بشكل واسع وكبير في الأنشطة الخلوية. البروتينات المترجمة (المشفرة) من هذا الجين تحتوي النطاق المحفوظ من بي اتش1, بي اتش4و بي بتش2. هذا البروتين يمكن أن تتفاعل مع أعضاء آخرين من عائلة البروتين بي سي إل 2 بما في ذلك بي سي إل2 بي سي إل2 إكس إل وبي أي إكس وقد تبين ان الترميز الزائد الغير متحكم به من هذا الجين لقمع موت الخلايا المبرمج قد يكون عن طريق منع إطلاق السيتوكروم سي من الميتوكوندريا، وبالتالي تفعيل كاسباس 3 التنشيط. تم العثور على نظير من هذا البروتين في الفئران الذي يتفاعل مع (أي بي أي إف 1) ويشكل بروتين معقد مع كاسباس 9، مما يشير إلى ان مسار هذا البروتين في (أي بي أي إف 1) وكاسباس 9 ذو صلة بالموت المبرمج.
بي سي إل2 - مثل بروتين13 (موت الخلايا المبرمج الميسر)، المعروف أيضا باسم بي سي إل2إل 13 أو بي سي إل رامبو، هو بروتين الذي يتم ترميز في البشر بواسطة الجين بي سي إل2إل 13 على الكروموسوم 22. هذا الجين يشفر أو يترجم البروتينات التي تتمركز في الميتوكوندريا والتي تصنف تحت عائلة البروتين Bcl-2. التشفير المفرط الغير متحكم به من البروتين يودي إلى موت الخلية المبرمج، وقد تورط في أنواع السرطان مثل سرطان الطفولة، سرطان الدم الحاد الليمفاوي، والأشكال ورم أرومي. وقد لوحظ العديد من النسخ بدلا من ذلك لهذا الجين، مثل بي سي إل رامبو بيتا.
: موت الخلايا المبرمج الميسر بي سي إل2 -مثل البروتين 14 هو البروتين الذي يتم ترميز في البشر بواسطة الجينات بي سي إل2إل 14 البروتين المشفرة بواسطة هذا الجين ينتمي إلى أسرة البروتين بي سي إل2. شكل أفراد الأسرة بي سي إل2 مغاير أو مماثلة (الأسرة تكون مركبات من جزيئات متماثلة أو مركبات من جزيئات غير متماثلة) ويكون بمثابة مكافحة أو موالي لمنظمات للموت المبرمج والذي يسهم في طائفة واسعة من الأنشطة الخلوية. وقد تبين أن التشفير المفرط من هذا الجين يحث على موت الخلايا المبرمج. أربع بدائل متنوعة تم نسخها بشكل متماثل ثم تم تشفيرها إلى ثلاثة أشباه لهذا البروتين.
بوك (بي سي إل2 المتعلقة القاتل للمبيض) هو جين تشفير البروتين من عائلة بي سي إل2 التي يتم العثور عليها في كثير من اللافقاريات والفقاريات. أنه يدفع الخلايا إلى نوع خاص من موت الخلايا.هذه الوظيفة وكيفية حدوثها غير معروفه حالياً.
اكتشاف وتناظر في عام 1997، تم التعرف على البروتين ذو الصلة ب بي سي إل2 القاتل لـ المبيض (بوك) في تجربة ثنائية هجينة من الخميرة مع مبيض فأرة به مكتبة كروموسومات الفئران في شاشة للبروتينات والتفاعل مع إ مسي إل 1، وهو بروتين وفر مكافح للموت المبرمج. النسخ والتشفير المفرطين من بوك يستحث موت الخلايا المبرمج. بسبب ارتفاعه تسلسل التشابه ل باك، باكسو بوك يصنف على أنه فرد من أفراد الأسرة بي سي إل2 ويطلق على جين الفائر المماثل ل بوك ماتادور (إم تي دي (.ويستمد هذا الاسم من ماكتاتور اللاتينية المصطلح الذي يعني جزار أو القاتل. بالإضافة إلى ذلك، تم العثور على البروتينات مثلي في ذبابة الفاكهة والدجاج.
تمايز الخلايا الذي يسببه سرطان الدم النخاعي البروتين إم مسي إل 1 هو البروتين الذي يشفر بواسطة الجين إم مسي إل 1 في البشر الوظيفة البروتين المشفرة بواسطة هذا الجين ينتمي إلى عائلة بي سي إل2. يحدث الربط البديل في هذا الموضع ويتم إنتاج نسختين من أشباه البروتين متميزة الترميز. الجين الأطول (الإسوي (الشبيه) 1) يعزز بقاء الخلية عن طريق تثبيط الخلايا.في حين أن الجين الأقصر (الإسوي (الشبيه) 2) يعزز موت الخلايا المبرمج وهو يعجل الموت.
بروتين ثلاثي هيدريد البورون أو البورين
[عدل]
تعتبر بروتين ثلاثي هيدريد البورون أو البورين الجزء الوحيد لمجموعه بي سي ال2 التي تشكل جزء مهم للشبكه التنظيميه والتي تعمل على دمج اشارات بقاء الخلية أو موتها حيث ان هذه العملية يتم دعمها بواسطة بروتين ثلاثي هيدريد البورون أو البورين. Egl-1 يعتبر جزء من نواه (خليه)|النواة المركزية المسؤوله عن الاشارات المركزية لموت الخلية. ان الية عمل البروتين في الخلية تبقى غير واضحه بشكل كامل، الا ان الدراسات الاخيره بشأن تنظيم تفاعلات كيميائية بين البروتينات الحيويه (ربط بروتين-بروتين) والنشاط السيء من قبل فسفرة وهذا النشاط يحدث ردا على اشارات التي تنشط عامل النمو وهذه الدراسات تشير إلى ان حالة النشاط في بروتين ثلاثي هيدريد البورون أو البورين يمكن تنظيمها من قبل النظام النسخي.[50] بروتين ثلاثي هيدريد البورون أو البورين يعمل على تعزيز موت العديد من أنواع الخلايا ولكن يتطلب وجود اما باكس أو باك حيث انهم يساعدو على حدوث الموت الخلوي أو الانتحار الخلوي للخلايا الذي يحدث عادة الثديات حيث يتم وضع باكس وباك في سلسله من الاحداث التي تعمل على تنشيط كاسباس، والبروتينات الفردية يتم تنشيطها كرد على بعض المحفزات موت الخلايا وليس أي نوع اخر من المحفزات.تدل المؤشرات على ان أنواع معينه من بروتين ثلاثي هيدريد البورون أو البورين قد تؤدي إلى تفعيل باكس وباك، وقد لوحظ ان وجود الشكل المنشط لبيد يمكن ان يحدث تغييرات بتكوين اما باكس اوباك حيث تم استخدام مجموعه كبيره من بروتينات ثلاثي هيدريد البورون أو البورين صناعيه لدراسه فعاليتها في الخلية، وقد لوحظ ان مجموعتين من هذه البروتينات يمكن ان تؤدي إلى ترابط المركبات كيميائيا لباكس اوباك بشكل مباشر لاطلاق سراح السيتوكرومات، وقد تم اختيار مصطلح «المنشطات» لوصف هذه القدرة بالذات.في حين ان البعض الآخر لم يستطع القيام بذلك واطلق عليها اسم «المحسسات» حيث انها لا تستطيع الارتباط مع المنشاط في المايتوكندريا ولا تستطيع تنشيط نفسها بشكل ذاتي.[51]
وهناك نموذجين من نماذج التفعيل باكس/باك من بروتين ثلاثي هيدريد البورون أو البورين:
-نموذج تفعيل مباشر: في هذا النموذج تكون بروتينات ثلاثي هيدريد البورون أو البورين المنشطه قادره على تفعيل وتنشيط باكس وباك بشكل مباشر وتمنع من القيام بذلك في الخلايا السليمه عن طريق البروتينات المؤيده للبقاء على قيد الحياة، وعند تلقي التحفيز يتم تنشيط بروتينات ثلاثي هيدريد البورون أو البورين من نوع «المحسسات» والتي ترتبط بالبروتينات المؤيده للبقاء لتحرير البروتينات «المنشطه» والتي تكون قد أصبحت قادره على التفاعل مع باكس/باك للحث على موت الخلايا المبرمج .
-نموذج التفعيل غير المباشر (التشريد): في هذا النموذج كل بروتينات ثلاثي هيدريد البورون أو البورين تحتاج إلى الارتباط ببعض الاعضاء المؤيده للبقاء للحصول على بعض الانشطه المؤيده للبروتين. بعض طفرة (أحياء) التي تحدث في الربط قد تؤدي إلى ضعف نشاط هذا البروتين.يختلف نظام التفعيل المباشر عن النظام الغير مباشر بدور البروتين في كل واحده منها ففي نموذج التفعيل الغير مباشر يتم الاحتفاظ بباكس/باك للاستخدام في الفحص من البروتينات المؤيده للبقاء على قيد الحياة من اجل تحرير الخلايا التي تعمل على تثبيط تكوين حمض نووي ريبوزي.وهذا النموذج لا يتطلب أي ربط أو تفاعل بين بروتين ثلاثي هيدريد البورون أو البورين وباكس/باك.
هل يعتبر بروتين ثلاثي هيدريد البورون مفتاح النجاح في علاج السرطان؟ تشارك هذه البروتينات في تثبيط الخلايا السرطانيه وايقاف تطوير أنواع السرطان وكذلك تعمل على تثبيط مقاوتها للعلاج وبالتالي، هناك مصلحة كبيرة في تطوير العوامل التي تعمل على استعادة العملية. ولذلك فإنه ليس من المستغرب أن يتم إنفاق الكثير من الجهد للعثور على جزيئات صغيرة التي تحاكي وظيفة البروتين ثلاثي هيدريد البورون أو البورين فقط كعوامل مضادة للسرطان.ان توسيع نطاق مفهوم بروتين ثلاثي هيدريد البورين يتم من خلال تنميط المبتوكوندريا مع الببتيدات لعلاج مرض السرطان بشكل كامل للمصاب وذلك باستخدام الادويه التي تعمل على تنشيط بروتين ثلاثي هيدريد البورين وقد أصبحت هذه الطريقة استراتيجيه واعده لعلاج مرض السرطان، في الاورام عند خسارة أو تثبيط بروتين ثلاثي هيدريد البورون أو البورين يؤدي ذلك إلى بدء موت الخلية المصابه بالورم.[52]
المراجع
[عدل]- ^ ا ب ج د ه و ز "InterPro Release 71.0". 8 نوفمبر 2018.
- ^ ا ب مذكور في: يونيبروت. الوصول: 13 نوفمبر 2019. معرف يونيبروت: P10415. لغة العمل أو لغة الاسم: الإنجليزية.
- ^ ا ب ج د ه و ز ح ط ي يا يب يج يد يه يو يز يح يط ك كا كب كج كد "GOA". اطلع عليه بتاريخ 2019-04-08.
- ^ ا ب ج Jean-Claude Martinou (18 Jul 1997). "Inhibition of Bax channel-forming activity by Bcl-2" (بالإنجليزية). pp. 370–2. Retrieved 2019-04-08.
- ^ ا ب "A common binding site mediates heterodimerization and homodimerization of Bcl-2 family members" (بالإنجليزية). 25 Apr 1997. pp. 11350–5. Retrieved 2018-07-16.
- ^ Guido Kroemer (3 Jan 2000). "The HIV-1 viral protein R induces apoptosis via a direct effect on the mitochondrial permeability transition pore" (بالإنجليزية). pp. 33–46. Retrieved 2019-04-08.
- ^ برت فوغلشتاين (Mar 2001). "PUMA induces the rapid apoptosis of colorectal cancer cells" (بالإنجليزية). pp. 673–82. Retrieved 2019-04-08.
- ^ Jose G. Teodoro (1 Sep 2009). "Identification of a protein, G0S2, that lacks Bcl-2 homology domains and interacts with and antagonizes Bcl-2" (بالإنجليزية). pp. 6782–9. Retrieved 2019-04-08.
- ^ "BNIPL-2, a novel homologue of BNIP-2, interacts with Bcl-2 and Cdc42GAP in apoptosis" (بالإنجليزية). 22 Aug 2003. pp. 379–85. Retrieved 2019-04-08.
- ^ Hans R. Widlund (14 Jun 2002). "Bcl2 regulation by the melanocyte master regulator Mitf modulates lineage survival and melanoma cell viability" (بالإنجليزية). pp. 707–18. Retrieved 2019-04-08.
- ^ "A common binding site mediates heterodimerization and homodimerization of Bcl-2 family members" (بالإنجليزية). 25 Apr 1997. pp. 11350–5. Retrieved 2019-04-08.
- ^ Frédéric Luciano (1 Oct 2008). "A short Nur77-derived peptide converts Bcl-2 from a protector to a killer" (بالإنجليزية). pp. 285–298. Retrieved 2019-04-08.
- ^ سوزان كوري (1 Feb 1998). "The conserved N-terminal BH4 domain of Bcl-2 homologues is essential for inhibition of apoptosis and interaction with CED-4" (بالإنجليزية). pp. 1029–1039. Retrieved 2019-04-08.
- ^ "GOA". اطلع عليه بتاريخ 2018-07-16.
- ^ "The immunolocalization of Bcl-2 in human term placenta" (بالإنجليزية). 1 Jan 2001. pp. 144–147. Retrieved 2019-04-08.
- ^ ا ب ج ستانلي جويل كورسمير (Sep 1995). "Role of BCL-2 in the survival and function of developing and mature sympathetic neurons" (بالإنجليزية). pp. 649–61. Retrieved 2019-04-08.
- ^ ا ب ج د ه و "GOA". اطلع عليه بتاريخ 2019-04-08.
- ^ كارلو إم. كروس (15 Aug 1992). "Overexpressed full-length human BCL2 extends the survival of baculovirus-infected Sf9 insect cells" (بالإنجليزية). pp. 7295–9. Retrieved 2019-04-08.
- ^ "GOA". اطلع عليه بتاريخ 2019-04-08.
- ^ "Prevention of apoptosis by Bcl-2: release of cytochrome c from mitochondria blocked" (بالإنجليزية). 21 Feb 1997. pp. 1129–32. Retrieved 2019-04-08.
- ^ "GOA". اطلع عليه بتاريخ 2018-07-16.
- ^ "GOA". اطلع عليه بتاريخ 2018-07-16.
- ^ "Prevention of apoptosis by Bcl-2: release of cytochrome c from mitochondria blocked" (بالإنجليزية). 21 Feb 1997. pp. 1129–32. Retrieved 2018-07-16.
- ^ "Investigation of the subcellular distribution of the bcl-2 oncoprotein: residence in the nuclear envelope, endoplasmic reticulum, and outer mitochondrial membranes" (بالإنجليزية). 1 Oct 1993. pp. 4701–14. Retrieved 2019-04-08.
- ^ مذكور في: دليل علم الأدوية. مُعرِّف ربيطة لدى الاتحاد الدولي لعلم الأدوية (IUPHAR): 8319. لغة العمل أو لغة الاسم: الإنجليزية. الوصول: 17 أغسطس 2016.
- ^ "Open Targets Platform". اطلع عليه بتاريخ 2023-08-14.
- ^ "Open Targets Platform". اطلع عليه بتاريخ 2023-08-14.
- ^ J.M. Adams, C.S. Cory Science, 281 (1998), pp. 1322–1325
- ^ J.M. Adams, C.S. Cory Science, 281 (1998), pp. 1322–1325
- ^ T. Chittenden, C. Flemington, A. Houghton, R. Ebb, G. Gallo, B. Elangovan, G. Chinnadurai, R. Lutz EMBO J., 14 (1995), pp. 5589–5596
- ^ A. Letai, M.C. Bassik, L.D. Walensky, M.D. Sorcinelli, S. Weiler, S.J. Korsmeyer Cancer Cell, 2 (2002), pp. 183–192
- ^ J.M. Adams, C.S. Cory Science, 281 (1998), pp. 1322–1325.
- ^ D.R. Green, J.C. Reed Science, 281 (1998), pp. 1309–1312
- ^ Muchmore, S. W.; Sattler, M.; Liang, H.; Meadows, R. P.; Harlan, J. E.; Yoon, H. S.; Nettesheim, D.; Chang, B. S.; Thompson, C. B. (1996-05-23). "X-ray and NMR structure of human Bcl-xL, an inhibitor of programmed cell death". Nature. 381 (6580): 335–341.
- ^ Reed JC, Zha H, Aime-Sempe C, Takayama S, Wang HG (1996). "Structure-function analysis of Bcl-2 family proteins. Regulators of programmed cell death". Adv. Exp. Med. Biol. 406: 99–112.
- ^ Bcl-2
- ^ https://www.biooncology.com/pathways/bcl-2/bcl-2-family-proteins.html
- ^ http://genesdev.cshlp.org/content/13/15/1899.full
- ^ D.E. Merry, D.J. Veis, W.F. Hickey, S.J. Korsmeyer bcl-2 protein expression is widespread in the developing nervous system and retained in the adult PNS Development, 120 (1994), p. 301
- ^ D.M. Hockenbery, M. Zutter, W. Hickey, M. Nahm, S.J. Korsmeyer BCL2 protein is topographically restricted in tissues characterized by apoptotic cell death Proc. Natl. Acad. Sci. U. S. A., 88 (1991), p. 6961
- ^ R. Merino, L. Ding, D.J. Veis, S.J. Korsmeyer, G. Nunez Developmental regulation of the Bcl-2 protein and susceptibility to cell death in B lymphocytes EMBO J., 13 (1994), p. 683
- ^ D.A. Fulcher, A. Basten Influences on the lifespan of B cell subpopulations defined by different phenotypes Eur. J. Immunol., 27 (1997), p. 1188
- ^ G. Nunez, D. Hockenbery, T.J. McDonnell, C.M. Sorensen, S.J. Korsmeyer Bcl-2 maintains B cell memory Nature, 353 (1991), p. 71
- ^ A. Strasser, S. Whittingham, D.L. Vaux, M.L. Bath, J.M. Adams, S. Cory, A.W. Harris Enforced BCL2 expression in B-lymphoid cells prolongs antibody responses and elicits autoimmune disease Proc. Natl. Acad. Sci. U. S. A., 88 (1991), p. 8661
- ^ G.P. Linette, M.J. Grusby, S.M. Hedrick, T.H. Hansen, L.H. Glimcher, S.J. Korsmeyer Bcl-2 is upregulated at the CD4+ CD8+ stage during positive selection and promotes thymocyte differentiation at several control points Immunity, 1 (1994), p. 197
- ^ C.L. Sentman, J.R. Shutter, D. Hockenbery, O. Kanagawa, S.J. Korsmeyer bcl-2 inhibits multiple forms of apoptosis but not negative selection in thymocytes Cell, 67 (1991), p. 879
- ^ P. Bouillet, J.F. Purton, D.I. Godfrey, L.C. Zhang, L. Coultas, H. Puthalakath, M. Pellegrini, S. Cory, J.M. Adams, A. Strasser BH3-only Bcl-2 family member Bim is required for apoptosis of autoreactive thymocytes Nature, 415 (2002), p. 922
- ^ A. Strasser, A.W. Harris, S. Cory bcl-2 transgene inhibits T cell death and perturbs thymic self-censorship Cell, 67 (1991), p. 889
- ^ A. Strasser, A.W. Harris, H. von Boehmer, S. Cory Positive and negative selection of T cells in T-cell receptor transgenic mice expressing a bcl-2 transgene Proc. Natl. Acad. Sci. U. S. A., 91 (1994), p. 1376
- ^ Role of the BH3 (Bcl-2 homology 3) domain in the regulation of apoptosis and Bcl-2-related proteins. - PubMed - NCBI نسخة محفوظة 13 يناير 2017 على موقع واي باك مشين.
- ^ Oncogene - BH3-only proteins and their roles in programmed cell death نسخة محفوظة 24 مايو 2016 على موقع واي باك مشين.
- ^ BH3-only proteins: Orchestrators of apoptosis - ScienceDirect نسخة محفوظة 11 يناير 2020 على موقع واي باك مشين.
