نصف خلية
المظهر

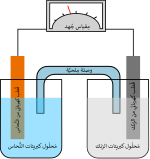
نصف الخلية[1][2] هو القطب الواحد من البطارية الكهربية ويمثل في التفاعل الكيميائي الحاصل في خلية دانيال على سبيل المثال أحد الكأسين، فالكأس الذي يحوي أيونات النحاس هو نصف خلية وهو في ذات الوقت مهبط الدائرة الكهربية الذي يحدث عنده عملية الاختزال وتسمى هذه العملية تفاعل نصف الخلية.[3]
أما الكأس الآخر الذي يحوي الخارصين (الزنك) هو نصف الخلية الآخر وكذلك هو مصعد الدائرة وتحدث عنده عملية الأكسدة ولكي يتم جريان التيار يجب توصيل الكأسين بناقلين كهربيين، وفي حالة دانيال فإن الناقل الأول هو الجلفانومتر وهو جهاز قياس الجهود المنخفضة والناقل الآخر هو القنطرة الملحية التي تقوم بوزن الأيونات في نصفي الخلية.
Zn + Cu+2 → Zn+2 + Cu :المعادلة الأصلية Zn → Zn+2 + 2e− :معادلة المصعد Cu+² + 2e− → Cu :معادلة المهبط
مراجع
[عدل]- ^ المعجم الموحد لمصطلحات الكيمياء: (إنجليزي - فرنسي - عربي)، سلسلة المعاجم الموحدة (5) (بالعربية والإنجليزية والفرنسية)، تونس: مكتب تنسيق التعريب، 1992، ص. 206 (103 H)، OCLC:982029990، QID:Q114804479
- ^ معجم مصطلحات الكيمياء (بالعربية والإنجليزية والفرنسية) (ط. 1)، دمشق: مجمع اللغة العربية بدمشق، 2014، ص. 227، OCLC:931065783، QID:Q113378673
- ^ Andrews، Donald H.؛ Richard J. Kokes (1962). "Electrochemistry". Fundamental Chemistry. New York: John Wiley & Sons, Inc. ص. 482.