وصف الطبقة الدهنية المزدوجة
وصف الطبقة الدهنية المزدوجة (الثنائية) هو استخدام طرق فحص بصرية وكيميائية وفيزيائية مختلفة لدراسة خصائص طبقات الدهون المزدوجة (الثنائية). العديد من هذه التقنيات معقدة وتتطلب معدات باهظة الثمن لأن الطبيعة الأساسية للطبقة الدهنية المزدوجة تجعلها ذات بنية صعبة للغاية في الدراسة. الطبقة المزدوجة الفردية، نظرًا لأن سمكها لا يتجاوز بضع نانومترات، فهو غير مرئي في الفحص المجهري للضوء التقليدي. تعتبر الطّبقة الثّنائية أيضاً ذات بنية هشة نسبيًا حيث يتم تثبيتها معًا بالكامل بواسطة روابط غير تساهمية، ويتم تدميرها بشكل لا رجعة فيه إذا تمت إزالتها من الماء. على الرغم من وجود مثل هذه القيود، فقد تم تطوير العشرات من التّقنيات على مدار السّبعين عامًا الماضية للسماح بالتحقيقات في هيكل ووظيفة الطبقات المزدوجة. كان النهج العام الأول هو استخدام القياسات غير المدمِرة في موقعه مثل انحراف الأشعة السينية والمقاومة الكهربائية التي تقيس خصائص الطبقة المزدوجة، ولكنها لم تصورها فعليًا. وفي وقت لاحق، تم تطوير بروتوكولات لتعديل الطبقة المزدوجة والسّماح بتصويرها المباشر بدايةً بواسطة المجهر الإلكتروني، ومؤخراً باستخدام الفحص المجهري الفلوري. على مدى العقدين الماضيين، سمح جيل جديد من أدوات التوصيف بما في ذلك مجهر القوة الذرية بالتحقيق والتصوير المباشر للأغشية في الموقع مع القليل من التعديل الكيميائي أو الفيزيائي أو بدونه. وفي الآونة الأخيرة، تم استخدام قياس التداخل ثنائي الاستقطاب لقياس الانكسار البصري للطبقات ثنائية الدهون لوصف النظام، والاضطراب المرتبط بـالتفاعلات أو التأثيرات البيئية.
التصوير المجهري التألقي
[عدل]
الفحص المجهري التألقي أو الفلوري هو تقنية يمكن من خلالها إثارة جزيئات معينة بـطول موجي واحد من الضوء وإصدار طول موجي آخر أطول من الضوء. نظرًا لأن كل جزيء فلوري له طيف فريد من الامتصاص والانبعاث، يمكن تحديد موقع أنواع معينة من الجزيئات. ولكن لا تتألق الدهون الطبيعية، لذلك من الضروري دائماً تضمين جزيء الصّبغة؛ لدراسة الطّبقات الثّنائية الدهون باستخدام الفحص المجهري الفلوري. إلى حد ما، تؤدي إضافة جزيء الصبغة دائماً إلى تغيير النظام، وفي بعض الحالات قد يكون من الصّعب تحديد ما إذا كان التّأثير الملحوظ ناتجاًعن الدّهون أو الصّبغة أو بشكل شائع مزيج من الإثنين. عادةً ما يتم ربط الصّبغة إما بدهن أو بجزيء يشبه إلى حد كبير الدهن، ولكن نظراً لأن مجال الصّبغة كبير نسبياً؛ فيمكنه تغيير سلوك هذا الجزيء الآخر. هذه قضية خلافية بشكل خاص عند دراسة انتشار أو مرحلة فصل الدّهون، حيث أن كلا العمليتين حساستان للغاية لحجم وشكل الجزيئات المعنية.
أعطت هذه المضاعفات المحتملة حجة ضد استخدام الاسترداد الفلوري بعد التبييض الضوئي (القصر الضوئي) لتحديد معاملات انتشار الطبقة الثنائية. في تجربة التبييض الضوئي النموذجية، يتم تبييض مساحة صغيرة (قطرها حوالي 30 ميكروميتر) عن طريق التّعرض لمصدر ضوء مكثف. يتم بعد ذلك مراقبة هذه المنطقة بمرور الوقت حيث تنتشر جزيئات الصبغة «الميتة» ويتم استبدالها بجزيئات الصبغة السّليمة من الطبقة الثنائية المحيطة. من خلال تركيب منحنى الاسترداد هذا، من الممكن حساب معامل الانتشار للطبقة الثنائية.[1][2] الحجة ضد استخدام هذه التقنية هي أن ما تتم دراسته بالفعل هو انتشار الصبغة، وليس الدهون.[3] على الرغم من صحة هذا التمييز، إلا أنه ليس مهمًا دائمًا، نظرًا لأن تنقل الصّبغة غالباً ما يهيمن عليه حركة الطبقة الثنائية.
في الفحص المجهري التقليدي الفلوري، تم تحديد الدقة إلى ما يقرب من نصف الطول الموجي للضوء المستخدم. من خلال استخدام الفحص المجهري متحد البؤر ومعالجة الصور يمكن تمديد هذا الحد، ولكن عادة لا يقل كثيراً عن 100 نانومتر، وهي أصغر بكثير من الخلية النموذجية ولكنها أكبر بكثير من سمك طبقة ثنائية الدهون. في الآونة الأخيرة، سمحت طرق الفحص المجهري المتقدمة بدرجة أكبر من الدّقة في ظل ظروف معينة، حتى وصولاً إلى أصغر من نانومتر. واحدة من أولى هذه الطرق التّي تم تطويرها كانت نقل طاقة الرنين التبييض الضوئي. وفي تجربة التبييض الضوئي، يتم اختيار جزيئين صبغ بحيث يتداخل طيف الانبعاث لأحدهما مع طيف الامتصاص للآخر. يعتمد نقل الطاقة هذا بشكل كبير على المسافة، لذلك من الممكن أن نعرف بدقة أنجستروم مدى التباعد بين الصبغتين. يمكن استخدام هذا على سبيل المثال لتحديد متى تندمج طبقتان ومكوناتهما.[4] تقنية مجهرية أخرى عالية الدقة وهي الفحص المجهري لتداخل أو اندماج التداخل الفلوري المتألق، تتطلب هذه الطريقة أن يتم تركيب العينة على سطح عاكس دقيق ميكانيكي. من خلال دراسة أنماط التداخل المدمرة المتكونة، من الممكن حل وريقتين من طبقة ثنائية مدعومة بشكل فردي وتحديد توزيع صبغة الفلورسنت في كل منهما.[5]
التصوير الكهربائي
[عدل]
القياسات الكهربائية هي الطريقة الأكثر مباشرةً لوصف إحدى الوظائف الأكثر أهمية للطبقة الثنائية، وهي قدرتها على الفصل ومنع تدفق الأيونات في المحلول. وبناءً عليه، كان الوصف أو التصوير الكهربائي من أولى الأدوات المستخدمة لدراسة خصائص الأنظمة النموذجية مثل الأغشية السوداء. كان معروفاً بالفعل أن غشاء الخلية كان قادراً على دعم التًدرج الأيوني وأن هذا التّدرج هو المسؤول عن قدرة الخلايا العصبية على إرسال إشارات عبر جهد فعل.وكان إثبات إمكانية تكرار ظواهر مماثلة في المختبر تَحَقُقاً مهمًا من فائدة أنظمة النماذج.[6] بشكل أساسي، تتضمن جميع القياسات الكهربائية للطبقات الثنائية وضع قطب كهربائي على جانبي الغشاء. من خلال تطبيق انحراف عبر هذه الأقطاب الكهربائية وقياس التيار الناتج، من الممكن تحديد مقاومة (إعاقة)الطّبقة الثنائية. عادةً ما تكون هذه المقاومة عالية جداً للطبقات الثنائية السليمة، وغالبًا ما تتجاوز100 جيجا؛ لأن اللُّب الكاره للماء غير مُنفِّذ للأنواع المائية المشحونة، وذلك لأن هذه المقاومة كبيرة جداً، فإن وجود عدد قليل من الثقوب بمقياس النانومتر يؤدي إلى زيادة كبيرة في التيار ويمكن تحديدها بسهولة.[7] إنّ حساسية هذا النِّظام من النّوع الذي يُمكنه حتى يحلل أو يميِّز نشاط القنوات الأيونية المفردة.[8] في مثل هذه القياسات للتيار المستمر، من الضروري استخدام أقطاب كهربائية نشطة كهربياً لتوفير الشّحنات الموجبة اللازمة من جانب والشحنات السالبة من الجانب الآخر. النّظام الأكثر شيوعاً هو استخدام قطب كهربائي من الفضة أو كلوريدالفضة؛ نظراً لأن هذا التّفاعل مستقر وقابل للانعكاس ويتضمن نقل إلكترون واحد ويمكن أن يُنتج تيارات كبيرة.[9] بالإضافة إلى القياسات البسيطة للتيار المستمر، من الممكن أيضاً إجراء الوصف الكهربائي للتيار المُتردد لاستخراج معلومات حول السعة والمقاومة المعقدة للطبقة الثنائية. نظراً لأن السّعة تتناسب عكساً مع السّماكة والطّبقات الثنائية الرقيقة جداً، فعادةً ما يكون لها سعة كبيرة جداً، في حدود 2 درجة فهرنهايت/سم2. تُعد قياسات السعة مفيدة بشكل خاص عند التعامل مع أغشية الدهون السوداء، حيث يمكن استخدامها لتحديد متى تنخفض سدادة المذيبات أوالدهون إلى طبقة ثنائية واحدة.
القياس البصري
[عدل]الدّهون: هي جزيئات ذات قطبية عالية والتي عند تجميعها ذاتياً في طبقات ثنائية تخلق طبقة شديدة الانكسار[10] حيث تكون الخصائص البصرية المتوازية مختلفة تماماً عن تلك المتعامدة. وتم استخدام هذا التأثير الذّي تمت دراسته بواسطة قياس التداخل ثنائي الاستقطاب لقياس إعادة التنظيم الديناميكي للطبقة؛ بسبب درجة الحرارة والقوة الأيونية والتفاعلات الجزيئية مع الببتيدات المضادة للـميكروبات على سبيل المثال.
تُظهر الطبقات الثنائية الرّطبة ديناميكيات اهتزازية غنية، وتعد وسائط جيدة لنقل الطاقة الاهتزازية بكفاءة.و تمت دراسة الخصائص الاهتزازية للطبقات الأحادية الدّهنية والطبقات الثنائية باستخدام تقنيات التّحليل الطّيفي فائقة السرعة[11] وطرق حسابية مطورة مؤخرراً.[12]

تم استخدام مجهر القوة الذرية (AFM) في السنوات الأخيرة لتصوير وفحص الخصائص الفيزيائية لطبقات ثنائية الدهون. استخدام مجهر القوة الذرية هي تقنية واعدة لأنها تتمتع بإمكانية التّصوير بـدقة نانومترية في درجة حرارة الغرفة وحتى تحت الماء، وهي ظروف ضرورية لسلوك الطّبقة الثّنائية الطّبيعية. سمحت هذه القدرات بالتّصوير المُباشر لتحول طور التموج الدقيق في طبقة ثنائية مدعومة.[13] سمحت تجربة AFM أخرى أجريت في وضع التّنصت تحت وسيط عازل مائي (1) لتحديد تكوين المسام عبر الغشاء (الثقوب) حول الجسيمات النانوية التي يبلغ قطرها من (1.2 -22 نانومتر) تقريبًا عن طريق طرح صور مجهر القوة الذرية من السلسلة المسجلة أثناء تكوين طبقة ثنائية الدهون و (2) لمراقبة امتصاص جزيئات الأنسولين المفردة على الجسيمات النانوية المكشوفة.[14] ميزة أخرى هي أن مجهر القوة الذرية لا يتطلب وضع العلامات الفلورية أو النظيرية للدهون، حيث يتفاعل طرف المسبار ميكانيكياً مع سطح الطّبقة الثنائية. لهذا السبب؛ يمكن أن يكشف الفحص نفسه عن معلومات حول كل من الطّبقة الثنائية وأي هياكل مرتبطة بها، حتى إلى حد حل بروتينات الغشاء الفردية.[15] بالإضافة إلى التصوير، يمكن لـمجهر القوة الذرية أيضًا التحقيق في الطبيعة الميكانيكية للهياكل الدقيقة الصغيرة مثل طبقات الدهون الثنائية. أظهرت إحدى الدراسات إمكانية قياس معامل المرونة للـأغشية النانوية الفردية المعلقة فوق الألومينا المسامية التي يسهل اختراقها.[16]
على الرغم من أن مجهر القوة الذرية أداة قوية ومتعددة الاستخدامات لدراسة طبقات الدهون الثنائية، إلا أن هناك بعض القيود والصعوبات العملية. بسبب الطبيعة الهشة للطبقة الثنائية، يجب استخدام قوى مسح منخفضة للغاية (عادةً 50pN أو أقل[13][13]) لتجنب الضرر. هذا الاعتبار مهم بشكل خاص عند دراسة الأنظمة شبه المستقرة مثل الحويصلات الممتصة على الدّعامة، لأن طرف مجهر القوة الذرية يمكن أن يؤدي إلى التمزق والتغيرات الهيكلية الأخرى.[13] يجب أيضًا توخي الحذر لاختيار مادة مناسبة وإعداد السطح لطرف مجهر القوة الذرية، حيث يمكن أن تتفاعل الأسطح الكارهة للماء بقوة مع الدهون وتعطل بُنية الطبقة الثنائية.[17]
الفحص باستخدام المجهر الإلكتروني
[عدل]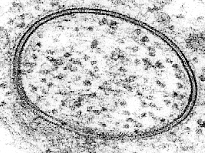
في المجهر الإلكتروني، تتفاعل حزمة من الإلكترونات المركزة مع العينة بدلاً من شعاع الضوء كما هو الحال في الفحص المجهري التقليدي. للإلكترونات طول موجي أقصر بكثير من الضوء، لذا فإن الفحص المجهري الإلكتروني له دقة أعلى بكثير من الفحص المجهري للضوء، ومن المحتمل أن يصل إلى النطاق الذري. وذلك لأن طبقات الدهون الثنائية مرتبة على المستوى الجزيئي، فإن هذا الدقة فائقة القيمة. في عام 1960م، عندما كان هيكل الطبقة الثنائية لا يزال محل نقاش، كان الفحص المجهري الإلكتروني هو الذي قدم أول تصور مباشرللنشرتين الموثقتين.[18] بالاقتران مع تقنيات التجميد السريع، تم استخدام المجهر الإلكتروني أيضًا لدراسة آليات النقل بين الخلايا وداخلها، على سبيلِ المثال؛ لإثبات أن الحويصلات الخارجة من الخلايا هي وسيلة لإطلاق المواد الكيميائية في مناطق التشابك.[19] غالبًا ما يكون المجهر الإلكتروني هو تقنية المسبار الوحيدة ذات الدقة الكافية لتحديد التشكلات المعقدة بمقياس النانومتر.
تتعامل قيود الفحص المجهري الإلكتروني في دراسة الهياكل الدهنية في المقام الأول على تحضير العينة. تتطلب معظم المجاهر الإلكترونية أن تكون العينة تحت التفريغ، وهو ما يتعارض مع الترطيب في درجة حرارة الغرفة. للتغلب على هذه المشكلة، يمكن تصوير العينات في ظروف التبريد الشديد مع تجميد المياه المصاحبة، أو يمكن عمل صورة سالبة معدنية من عينة مجمدة. من الضروري أيضاً عادةً تلطيخ الطّبقة الثنائية بمركب معدني ثقيل مثل رباعي أكسيد الأوزميوم أو أسيتات اليورانيل لأن المكونات ذات الوزن الذري المنخفض للدهون (الكربون والنيتروجين والفوسفور، إلخ) تقدم تباينًا ضئيلًا مقارنةً بالماء. إذا تم استخدام مجهر إلكتروني ناقل (المجهر الإلكتروني للإرسال)، فمن الضروري أيضًا قطع العينة أو تلميعها في ورقة رقيقة جداً (أقل من 1 ميكرومتر)، والتي قد تكون صعبة وتستغرق وقتًا طويلاً. لا يتطلب الفحص المجهري الإلكتروني (مجهر المسح الالكتروني) هذه الخطوة، ولكن لا يمكنه تقديم نفس الدقة مثل المجهر الإلكتروني للإرسال. تعتبر كلتا الطريقتين تقنيات حساسة للسطح ولا يمكنها الكشف عن معلومات حول الهياكل المدفونة بعمق.
تشتت النيوترونات والأشعة السينية
[عدل]تُستخدم كل من الأشعة السينية والنيوترونات عالية الطاقة لسَبر أو فحص بنية ودورية الهياكل البيولوجية بما في ذلك الطبقات الثنائية؛ لأنه يمكن ضبطها للتفاعل مع المادة بمقاييس الطول ذات الصلة (أنجستروم -نانومتر). غالبًا ما توفر هاتان الفئتان من التّجارب معلومات تكميلية لأن لكل منهما مزايا وعيوب مختلفة. تتفاعل الأشعة السينية بشكل ضعيف مع الماء فقط، لذلك يمكن فحص العينات السائبة من خلال تحضير عينة سهل نسبياً. هذا هو أحد الأسباب التي جعلت نثر الأشعة السينية هو التقنية المستخدمة لأول مرة لدراسة التباعد بين الطبقات بشكل منهجي.[20] يمكن أن ينتج عن تشتت الأشعة السينية أيضاً معلومات عن متوسط التباعد بين جزيئات الدّهون الفردية، مما أدى إلى استخدامه في توصيف أو تصوير انتقالات الطور.[21] أحد قيود تقنيات الأشعة السينية هو أن الأشعة السينية غير حساسة نسبياً لعناصر الضّوء مثل الهيدروجين. هذا التأثير هو نتيجة حقيقة أن الأشعة السينية تتفاعل مع المادة عن طريق تشتت كثافة الإلكترون التي تتناقص مع تناقص العدد الذري. في المقابل، تشتت النيوترونات من الكثافة النووية والمجالات المغناطيسية النووية، لذا لا تنخفض الحساسية بشكل رتيب مع العدد الذري أو عدد البروتونات. توفر هذه الآلية أيضاً تبايناً نظيرياً قوياً في بعض الحالات، لا سيما بين الهيدروجين والديوتيريوم، مما يسمح للباحثين بضبط خط الأساس التّجريبي عن طريق خلط الماء والماء منزوع الدوتريوم. يسمح استخدام القياس الانعكاسي بدلاً من التشتت بالنيوترونات أو الأشعة السينية للمُجرِّبين بسبر أو فحص الطبقات الثنائية المدعومة أوالمخازن متعددة الطبقات. هذه القياسات أكثر تعقيداً لإجراء التّحليل، ولكنها تسمح بتحديد تكوين المقطع العرضي، بما في ذلك موقع وتركيز الماء داخل الطبقة الثنائية.[22] وفي حالة كل من قياسات تشتت النيوترون والأشعة السينية، فإن المعلومات المقدمة هي متوسط مُجَمع للنظام وبالتالي فهي عرضة لعدم اليقين بناءً على التقلبات الحرارية في هذه الهياكل عالية الحركة.[23]
المراجع
[عدل]- ^ D. Axelrod, D. E. Koppel, J. Schlessinger, E. Elson and W. W. Webb."Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. ." Biophysical Journal. 16. (1976) 1055-69.
- ^ D. M. Soumpasis."Theoretical analysis of fluorescence photobleaching recovery experiments." Biophysical Journal. 41. (1983) 95-7.
- ^ W. L. Vaz and P. F. Almeida."Microscopic versus macroscopic diffusion in one-component fluid phase lipid bilayer membranes." Biophysical Journal. 60. (1991) 1553-1554.
- ^ L. Guohua and R. C. Macdonald."Lipid bilayer vesicle fusion: Intermediates captured by high-speed microfluorescence spectroscopy." Biophysical Journal. 85. (2003) 1585-1599.
- ^ J. M. Crane, V. Kiessling and L. K. Tamm."Measuring lipid asymmetry in planar supported bilayers by fluorescence interference contrast microscopy." Langmuir. 21. (2005) 1377-1388.
- ^ P. Mueller, D. O. Rudin, H. I. Tien and W. C. Wescott."Reconstitution of cell membrane structure in vitro and its transformation into an excitable system." Nature. 194. (1962) 979-980.
- ^ K. C. Melikov, V. A. Frolov, A. Shcherbakov, A. V. Samsonov, Y. A. Chizmadzhev and L. V. Chernomordik."Voltage-Induced Nonconductive Pre-Pores and Metastable Single Pores in Unmodified Planar Lipid Bilayer " Biophysical Journal. 80. (2001) 1829-1836.
- ^ E. Neher and B. Sakmann."Single-channel currents recorded from membrane of denervated frog muscle fibres " Nature. 286. (1976) 71-73.
- ^ D. T. Sawyer, "Electrochemistry for Chemists". 2nd Ed. 1995: Wiley Interscience.
- ^ Alireza Mashaghi et al. Optical anisotropy of supported lipid structures probed by waveguide spectroscopy and its application to study of supported lipid bilayer formation kinetics Anal. Chem., 80 (10), 3666–3676 (2008)
- ^ M. Bonn et al., Structural inhomogeneity of interfacial water at lipid monolayers revealed by surface-specific vibrational pump-probe spectroscopy, J. Am. Chem. Soc. 132, 14971–14978 (2010).
- ^ Mischa Bonn et al., Interfacial Water Facilitates Energy Transfer by Inducing Extended Vibrations in Membrane Lipids, J Phys Chem, 2012 http://pubs.acs.org/doi/abs/10.1021/jp302478a نسخة محفوظة 2019-08-09 على موقع واي باك مشين.
- ^ ا ب ج د T. Kaasgaard, C. Leidy, J. H. Crowe, O. E. Mouritsen and K. Jorgensen."Temperature-Controlled Structure and Kinetics of Ripple Phases in One- and Two-Component Supported Lipid Bilayers " Biophysical Journal. 85. (2003) 350-360.
- ^ Y. Roiter, M. Ornatska, A. R. Rammohan, J. Balakrishnan, D. R. Heine, and S. Minko, Interaction of Nanoparticles with Lipid Membrane, Nano Letters, vol. 8, iss. 3, pp. 941-944 (2008). نسخة محفوظة 10 سبتمبر 2021 على موقع واي باك مشين.
- ^ R. P. Richter and A. Brisson."Characterization of lipid bilayers and protein assemblies supported on rough surfaces by atomic force microscopy." Langmuir. 19. (2003) 1632-1640.
- ^ S. Steltenkamp, M. M. Muller, M. Deserno, C. Hennesthal, C. Steinem and A. Janshoff."Mechanical properties of pore-spanning lipid bilayers probed by atomic force microscopy." Biophysical Journal. 91. (2006) 217-226.
- ^ J. Schneider, W. Barger and G. U. Lee."Nanometer scale surface properties of supported lipid bilayers measured with hydrophobic and hydrophilic atomic force microscope probes." Langmuir. 19. (2003) 1899-1907.
- ^ J. D. Robertson."The molecular structure and contact relationships of cell membranes." Progress Biophysics and Biophysical Chemistry. 10. (1960) 343-418.
- ^ J. E. Heuser, T. S. Reese, M. J. Dennis, Y. Jan, L. Jan and L. Evans."Synaptic vesicle exocytosis captured by quick freezing and correlated with quantal transmitter release." Journal of Cell Biology. 81. (1979) 275-300.
- ^ D. Papahadjapoulos and N. Miller."Phospholipid Model Membranes I. Structural characteristics of hydrated liquid crystals." Biochimica et Biophysica Acta. 135. (1967) 624-638.
- ^ D. M. Small."Phase equilibria and structure of dry and hydrated egg lecithin " Journal of Lipid Research. 8. (1967) 551-557.
- ^ G. Zaccai, J. K. Blasie and B. P. Schoenborn."Neutron diffraction studies on the location of water in lecithin bilayer model membranes." Proceedings of the National Academy of Sciences of the United States of America. 72. (1975) 376-380.
- ^ D. Boal, "Mechanics of the Cell". 2002, Cambridge, UK: Cambridge University Press.
