أحادي أكسيد ثنائي الكبريت
| أحادي أكسيد ثنائي الكبريت | |
|---|---|
| أسماء أخرى | |
Disulfur monoxide |
|
| المعرفات | |
| CAS | 20901-21-7 |
| بوب كيم | 140772 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
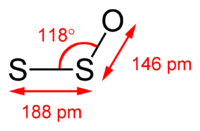
| الصيغة الجزيئية | S2O |
| الكتلة المولية | 80.13 غ/مول |
| المظهر | غاز عديم اللون |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
أحادي أكسيد ثنائي الكبريت هو مركب لاعضوي صيغته S2O، ويوجد على شكل غاز عديم اللون؛ وهو ينتمي إلى مجموعة مركبات تحت أكاسيد الكبريت غير المستقرة.[2]
الوفرة الكونية[عدل]
يمكن أن يعثر على آثار من أحادي أكسيد ثنائي الكبريت في الغلاف الجوي لقمر آيو، أحد أقمار المشتري.[3][4]
التحضير[عدل]
يمكن أن يحضر المركب من تفاعل بخار كلوريد الثيونيل مع كبريتيد الفضة عند الدرجة 160 °س.[5]
وهي طريقة تمكن من الحصول على الناتج بنقاوة جيدة، في حين أن تفاعل الكبريت مع الأكسجين أو أكسيد النحاس الثنائي لا يعطي ناتجاً نقياً.[5]
يمكن أن يتشكل المركب من تفكك أحادي أكسيد الكبريت:[2]
أو من تفاعله مع الكبريت:[6]
أو من التفكك الحراري لمركب ثنائي أكسيد الكبريت وفق أسلوب التفريغ التوهجي.[7]
الخواص[عدل]
في شروط تحضير المركب يكون أحادي أكسيد ثنائي الكبريت على شكل غاز عديم اللون، ولكن يمكن الحصول على شكل صلب متكثف منه ضمن شروط خاصة،[2][8] حيث يبدي حزم امتصاص عند 420 و530 نانومتر.[9]
للمركب بنية جزيئية منحنية، وتبلغ زاوية الرابطة S−S−O مقدار 117.88°؛ وطول الرابطة S−S مقدار 188.4 بيكومتر، وطول الرابطة S−O مقدار 146.5 بيكومتر.[10]
طالع أيضاً[عدل]
مراجع[عدل]
- ^ أ ب ت Disulfur monoxide (بالإنجليزية), QID:Q278487
- ^ أ ب ت R. Steudel: Sulfur-Rich Oxides SnO and SnO2" in Elemental Sulfur und Sulfur-Rich Compounds II, Steudel, R., 2003, Springer, Berlin-Heidelberg. (ردمك 9783540449515)
- ^ Volcanic origin of disulfur monoxide S2O on Io, M. Y. Zolotov, und B. Fegley. Icarus 133(2):293--297 (1998).
- ^ Mikhail Yu. Zolotov and Bruce Fegley (9 مارس 1998). "Volcanic Origin of Disulfur Monoxide (S2O) on Io" (PDF). Icarus. ج. 133 ع. 2: 293. Bibcode:1998Icar..133..293Z. DOI:10.1006/icar.1998.5930. مؤرشف من الأصل (PDF) في 2017-10-10.
- ^ أ ب A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 574.
- ^ Peter W. Schenk, Werner Holst: Über das Schwefelmonoxid. XIV. Versuche zur Reindarstellung des S2O. In: Zeitschrift für anorganische und allgemeine Chemie. 319, 1963, S. 337–349, دُوِي:10.1002/zaac.19633190515.
- ^ Cotton and Wilkinson (1966). Advanced Inorganic Chemistry: A Comprehensive Treatise. ص. 540.
- ^ B Hapke and F Graham (مايو 1989). "Spectral properties of condensed phases of disulfur monoxide, polysulfur oxide, and irradiated sulfur". Icarus. ج. 79 ع. 1: 47. Bibcode:1989Icar...79...47H. DOI:10.1016/0019-1035(89)90107-3.
- ^ Meschi، D. J.؛ Myers، R. J. (1959). "The microwave spectrum, structure, and dipole moment of disulfur monoxide". Journal of Molecular Spectroscopy. ج. 3 ع. 1–6: 405–416. Bibcode:1959JMoSp...3..405M. DOI:10.1016/0022-2852(59)90036-0.
| أحادي أكسيد ثنائي الكبريت في المشاريع الشقيقة: | |
| |