إنزيم انشقاق سلسلة الكوليسترول الجانبية
| cytochrome P450 family 11 subfamily A member 1 | |||||||
|---|---|---|---|---|---|---|---|
| معرفات | |||||||
| أسماء بديلة | cytochrome P450 11A1, cytochrome P450(scc), CYP11A1, cholesterol 20-22 desmolase, cholesterol side-chain cleavage enzyme, mitochondrial, cytochrome P450 family 11 subfamily A polypeptide 1, cholesterol monooxygenase (side-chain cleaving), cytochrome P450, subfamily XIA (cholesterol side chain cleavage), steroid 20-22-lyase, CYPXIA1, cholesterol desmolase | ||||||
| معرفات خارجية | |||||||
| نمط التعبير عن الحمض النووي الريبوزي | |||||||
 |
|||||||
| المزيد من بيانات التعبير المرجعية | |||||||
| تماثلات متسلسلة | |||||||
| أنواع | الإنسان | الفأر | |||||
| أنتريه | n/a | ||||||
| Ensembl | n/a | n/a | |||||
| يونيبروت |
|
| |||||
| RefSeq (رنا مرسال.) |
|
| |||||
| RefSeq (بروتين) |
|
| |||||
| الموقع (UCSC | n/a | ||||||
| بحث ببمد | n/a | ||||||
| ويكي بيانات | |||||||
| |||||||
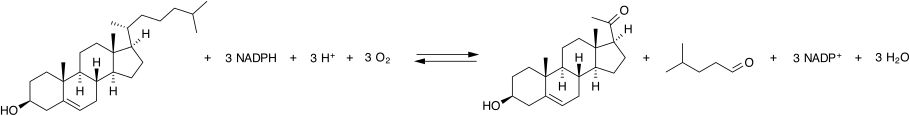
إنزيم انشقاق سلسلة الكوليسترول الجانبية يُشار إليه عادةً باسم P450scc، حيث "scc" هو اختصار لانشقاق السلسلة الجانبية. P450scc هو إنزيم ميتوكوندري يحفز تحويل الكوليسترول إلى بريجنينولون. هذا هو التفاعل الأول في عملية تكوين الستيرويد في جميع الأنسجة الثديية التي تخصصت في إنتاج مختلف الهرمونات الستيرويدية.[1]
P450scc هو عضو في عائلة سيتوكروم بي450 من الإنزيمات (العائلة 11، الفصيلة A، الببتيد 1) ويتم ترميزه بواسطة الجين CYP11A1.[2]
التسمية
[عدل]| كوليسترول مونوأوكسيجيناز (انشقاق السلسلة الجانبية) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| أرقام التعريف | |||||||||||
| رقم التصنيف الإنزيمي | 1.14.15.6 | ||||||||||
| رقم التسجيل CAS | 37292-81-2 | ||||||||||
| قواعد البيانات | |||||||||||
| قاعدة بيانات الإنزيم | راجع IntEnz | ||||||||||
| قاعدة بيانات براونشفايغ | راجع BRENDA | ||||||||||
| إكسباسي | راجع NiceZyme | ||||||||||
| موسوعة كيوتو | راجع KEGG | ||||||||||
| ميتاسيك | المسار الأيضي | ||||||||||
| بريام | ملف التعريف | ||||||||||
| تركيب بنك بيانات البروتين | RCSB PDB PDBe PDBsum | ||||||||||
| الأونتولوجيا الجينية | AmiGO / EGO | ||||||||||
| |||||||||||
الاسم النظامي لهذا الإنزيم هو كوليسترول، فيريدوكسين-أدرينالين مخفض:أوكسجين أوكسيدوريدوكتاز (انشقاق السلسلة الجانبية). تشمل الأسماء الأخرى:
|
توطين الأنسجة والخلايا
[عدل]يوجد أعلى مستوى لنظام انشقاق السلسلة الجانبية للكوليسترول في قشرة الغدة الكظرية والجسم الأصفر.[1] يتم التعبير عن النظام أيضًا بمستويات عالية في خلايا الثيكا الستيرويدية في المبيض وخلايا بينية في الخصية.[1] أثناء الحمل، تعبر المشيمة أيضًا عن مستويات كبيرة من هذا النظام الإنزيمي.[3] يوجد P450scc أيضًا بمستويات أقل في عدة أنواع أخرى من الأنسجة، بما في ذلك الدماغ.[4] في قشرة الغدة الكظرية، يكون تركيز أدرينودوكسين مشابهًا لتركيز P450scc، ولكن يتم التعبير عن أدرينودوكسين ريدوكتاز بمستويات أقل.[5]
أظهرت دراسات المناعة المتألقة باستخدام أجسام مضادة محددة ضد إنزيمات نظام P450scc أن البروتينات موجودة حصريًا داخل الميتوكوندريا.[6][7] يرتبط P450scc بالغشاء الداخلي للميتوكوندريا، مواجهًا الداخل (المصفوفة).[8][9] أدرينودوكسين وأدرينودوكسين ريدوكتاز هما بروتينان غشائيان طرفيان قابلان للذوبان موجودان داخل مصفوفة الميتوكوندريا ويبدو أنهما يرتبطان ببعضهما بشكل أساسي من خلال التفاعلات الكهروستاتيكية.[10]
آلية العمل
[عدل]يحفز P450scc تحويل الكوليسترول إلى بريجنينولون في ثلاث تفاعلات أحادية الأكسجين. تتضمن هذه التفاعلات هيدروكسلة السلسلة الجانبية للكوليسترول مرتين، مما ينتج أولاً 22R-هيدروكسي كوليسترول ثم 20α,22R-ثنائي هيدروكسي كوليسترول. الخطوة الأخيرة تقطع الرابطة بين الكربونات 20 و22، مما يؤدي إلى إنتاج بريجنينولون وألدهيد إيزوكابرويك.
تتطلب كل خطوة أحادية الأكسجين إلكترونين (معادلات اختزال). المصدر الأولي للإلكترونات هو NADPH.[11] يتم نقل الإلكترونات من NADPH إلى P450scc عبر بروتينين لنقل الإلكترونات: أدرينودوكسين ريدوكتاز[12] وأدرينودوكسين.[13][14] تشكل جميع البروتينات الثلاثة معًا مركب انشقاق السلسلة الجانبية للكوليسترول.
تثير مشاركة ثلاثة بروتينات في تفاعل انشقاق السلسلة الجانبية للكوليسترول السؤال عما إذا كانت البروتينات الثلاثة تعمل كمركب ثلاثي مثل ريدوكتاز:أدرينودوكسين:P450. أظهرت الدراسات الطيفية لارتباط أدرينودوكسين بـ P450scc والدراسات الحركية في وجود تركيزات متغيرة من أدرينودوكسين ريدوكتاز أن الريدوكتاز يتنافس مع P450scc للارتباط بأدرينودوكسين. هذه النتائج أظهرت أن تشكيل مركب ثلاثي وظيفي ليس ممكنًا.[13] من هذه الدراسات، تم استنتاج أن مواقع ارتباط أدرينودوكسين بريدوكتازه و P450 متداخلة، ونتيجة لذلك، يعمل أدرينودوكسين كمركب نقل إلكترون متنقل بين الريدوكتاز و P450.[13] تم تأكيد هذه الاستنتاجات من خلال التحليل الهيكلي لمركب أدرينودوكسين و P450.[15]
عملية نقل الإلكترونات من NADPH إلى P450scc ليست مقترنة بشكل محكم؛ أي أنه أثناء نقل الإلكترونات من أدرينودوكسين ريدوكتاز عبر أدرينودوكسين إلى P450scc، يتسرب جزء معين من الإلكترونات خارج السلسلة ويتفاعل مع O2، مما يولد جذورًا فائقة.[16] تحتوي الخلايا الستيرويدية على مجموعة متنوعة من أنظمة مضادات الأكسدة للتعامل مع الجذور التي تولدها الإنزيمات الستيرويدية.[17]
التنظيم
[عدل]في كل خلية ستيرويدية، يتم تنظيم التعبير عن بروتينات نظام P450scc بواسطة النظام الهرموني الغذائي المحدد لنوع الخلية.[1] في خلايا قشرة الغدة الكظرية من منطقة الحزمة، يتم تحفيز التعبير عن الرنا المرسال الذي يرمز لجميع بروتينات P450scc بواسطة الهرمون الموجه لقشر الكظرية (ACTH).[7][18] تزيد الهرمونات الغذائية من التعبير عن الجين CYP11A1 من خلال عوامل النسخ مثل عامل ستيرويدوجينيك 1 (SF-1)، بواسطة النظير α لبروتين تنشيط 2 (AP-2) في الإنسان، والعديد من العوامل الأخرى.[18][19] يتم تثبيط إنتاج هذا الإنزيم بشكل ملحوظ بواسطة المستقبل النووي DAX-1.[18]
P450scc دائمًا نشط، ولكن نشاطه محدود بمدى توفر الكوليسترول في الغشاء الداخلي. وبالتالي، يعتبر توفير الكوليسترول لهذا الغشاء (من الغشاء الخارجي للميتوكوندريا) الخطوة الحقيقية المحددة لمعدل إنتاج الستيرويد. تتم هذه الخطوة بشكل أساسي بواسطة بروتين تنظيم الستيرويد الحاد (StAR أو STARD1). عند تحفيز الخلية لإنتاج الستيرويد، فإن كمية StAR المتاحة لنقل الكوليسترول إلى الغشاء الداخلي تحدد مدى سرعة التفاعل (المرحلة الحادة). مع التحفيز المطول (المزمن)، يُعتقد أن توفير الكوليسترول لم يعد مشكلة وأن قدرة النظام على إنتاج الستيرويد (أي مستوى P450scc في الميتوكوندريا) أصبحت الآن أكثر أهمية.
الكورتيكوتروبين (ACTH) هو هرمون يتم إطلاقه من الغدة النخامية الأمامية استجابةً لحالات التوتر. أظهرت دراسة عن القدرة الستيرويدية لقشرة الغدة الكظرية في الرضع المصابين بأمراض الجهاز التنفسي الحادة أنه بالفعل أثناء حالة المرض هناك زيادة محددة في القدرة الستيرويدية لتخليق الكورتيزول الجلوكوكورتيكويد ولكن ليس للألدوستيرون المعدني أو DHEAS الأندروجين الذي يتم إفرازه من مناطق أخرى من قشرة الغدة الكظرية.[20]
الأمراض المرتبطة
[عدل]تؤدي الطفرات في جين CYP11A1 إلى نقص في الهرمونات الستيرويدية، مما يتسبب في حالات نادرة من تضخم الغدة الكظرية الخلقي الشحمي، وهي حالة نادرة وقد تكون قاتلة.[21][22][23] يمكن أن يؤدي نقص CYP11A1 إلى فرط التصبغ، نقص السكر في الدم، والالتهابات المتكررة.[24]
مثبطات الإنزيم
[عدل]تشمل مثبطات إنزيم انشقاق السلسلة الجانبية للكوليسترول أمينوغلوتيثيميد، كيتوكونازول، وميتوتان، وغيرها.[25][26][27]
انظر أيضًا
[عدل]المراجع
[عدل]- ^ ا ب ج د Hanukoglu I (ديسمبر 1992). "Steroidogenic enzymes: structure, function, and role in regulation of steroid hormone biosynthesis". The Journal of Steroid Biochemistry and Molecular Biology. ج. 43 ع. 8: 779–804. DOI:10.1016/0960-0760(92)90307-5. PMID:22217824. S2CID:112729. مؤرشف من الأصل في 2023-05-12.
- ^ "Entrez Gene: CYP11A1 cytochrome P450, family 11, subfamily A, polypeptide 1".
- ^ Strauss JF، Martinez F، Kiriakidou M (فبراير 1996). "Placental steroid hormone synthesis: unique features and unanswered questions". Biology of Reproduction. ج. 54 ع. 2: 303–311. DOI:10.1095/biolreprod54.2.303. PMID:8788180.
- ^ Stoffel-Wagner B (ديسمبر 2001). "Neurosteroid metabolism in the human brain". European Journal of Endocrinology. ج. 145 ع. 6: 669–679. DOI:10.1530/eje.0.1450669. PMID:11720889.
- ^ Hanukoglu I، Hanukoglu Z (مايو 1986). "Stoichiometry of mitochondrial cytochromes P-450, adrenodoxin and adrenodoxin reductase in adrenal cortex and corpus luteum. Implications for membrane organization and gene regulation". European Journal of Biochemistry. ج. 157 ع. 1: 27–31. DOI:10.1111/j.1432-1033.1986.tb09633.x. PMID:3011431. مؤرشف من الأصل في 2023-08-26.
- ^ Hanukoglu I، Suh BS، Himmelhoch S، Amsterdam A (أكتوبر 1990). "Induction and mitochondrial localization of cytochrome P450scc system enzymes in normal and transformed ovarian granulosa cells". The Journal of Cell Biology. ج. 111 ع. 4: 1373–1381. DOI:10.1083/jcb.111.4.1373. PMC:2116250. PMID:2170421.
- ^ ا ب Hanukoglu I، Feuchtwanger R، Hanukoglu A (نوفمبر 1990). "Mechanism of corticotropin and cAMP induction of mitochondrial cytochrome P450 system enzymes in adrenal cortex cells". The Journal of Biological Chemistry. ج. 265 ع. 33: 20602–20608. DOI:10.1016/S0021-9258(17)30545-8. PMID:2173715. مؤرشف من الأصل في 2023-10-11.
- ^ Topological studies of cytochromes P-450scc and P-45011 beta in bovine adrenocortical inner mitochondrial membranes. Effects of controlled tryptic digestion. J. Biol. Chem. 1979 254: 10443-8.
- ^ Farkash Y، Timberg R، Orly J (أبريل 1986). "Preparation of antiserum to rat cytochrome P-450 cholesterol side chain cleavage, and its use for ultrastructural localization of the immunoreactive enzyme by protein A-gold technique". Endocrinology. ج. 118 ع. 4: 1353–1365. DOI:10.1210/endo-118-4-1353. PMID:3948785.
- ^ Hanukoglu I، Privalle CT، Jefcoate CR (مايو 1981). "Mechanisms of ionic activation of adrenal mitochondrial cytochromes P-450scc and P-45011 beta". The Journal of Biological Chemistry. ج. 256 ع. 9: 4329–4335. DOI:10.1016/S0021-9258(19)69437-8. PMID:6783659.
- ^ Hanukoglu I، Rapoport R (1995). "Routes and regulation of NADPH production in steroidogenic mitochondria". Endocrine Research. ج. 21 ع. 1–2: 231–241. DOI:10.3109/07435809509030439. PMID:7588385.
- ^ Hanukoglu I، Gutfinger T، Haniu M، Shively JE (ديسمبر 1987). "Isolation of a cDNA for adrenodoxin reductase (ferredoxin-NADP+ reductase). Implications for mitochondrial cytochrome P-450 systems". European Journal of Biochemistry. ج. 169 ع. 3: 449–455. DOI:10.1111/j.1432-1033.1987.tb13632.x. PMID:3691502.
- ^ ا ب ج Hanukoglu I، Jefcoate CR (أبريل 1980). "Mitochondrial cytochrome P-450scc. Mechanism of electron transport by adrenodoxin". The Journal of Biological Chemistry. ج. 255 ع. 7: 3057–3061. DOI:10.1016/S0021-9258(19)85851-9. PMID:6766943.
- ^ Hanukoglu I، Spitsberg V، Bumpus JA، Dus KM، Jefcoate CR (مايو 1981). "Adrenal mitochondrial cytochrome P-450scc. Cholesterol and adrenodoxin interactions at equilibrium and during turnover". The Journal of Biological Chemistry. ج. 256 ع. 9: 4321–4328. DOI:10.1016/S0021-9258(19)69436-6. PMID:7217084.
- ^ Strushkevich N، MacKenzie F، Cherkesova T، Grabovec I، Usanov S، Park HW (يونيو 2011). "Structural basis for pregnenolone biosynthesis by the mitochondrial monooxygenase system". Proceedings of the National Academy of Sciences of the United States of America. ج. 108 ع. 25: 10139–10143. Bibcode:2011PNAS..10810139S. DOI:10.1073/pnas.1019441108. PMC:3121847. PMID:21636783.
- ^ Hanukoglu I، Rapoport R، Weiner L، Sklan D (سبتمبر 1993). "Electron leakage from the mitochondrial NADPH-adrenodoxin reductase-adrenodoxin-P450scc (cholesterol side chain cleavage) system". Archives of Biochemistry and Biophysics. ج. 305 ع. 2: 489–498. DOI:10.1006/abbi.1993.1452. PMID:8396893. مؤرشف من الأصل في 2023-09-18.
- ^ Hanukoglu I (2006). "Antioxidant protective mechanisms against reactive oxygen species (ROS) generated by mitochondrial P450 systems in steroidogenic cells". Drug Metabolism Reviews. ج. 38 ع. 1–2: 171–196. DOI:10.1080/03602530600570040. PMID:16684656. S2CID:10766948. مؤرشف من الأصل في 2023-09-18.
- ^ ا ب ج Lavoie HA، King SR (أغسطس 2009). "Transcriptional regulation of steroidogenic genes: STARD1, CYP11A1 and HSD3B". Experimental Biology and Medicine. ج. 234 ع. 8: 880–907. DOI:10.3181/0903-MR-97. PMID:19491374. S2CID:5350278.
- ^ Guo IC، Shih MC، Lan HC، Hsu NC، Hu MC، Chung BC (يوليو 2007). "Transcriptional regulation of human CYP11A1 in gonads and adrenals". Journal of Biomedical Science. ج. 14 ع. 4: 509–515. DOI:10.1007/s11373-007-9177-z. PMID:17594537.
- ^ Hanukoglu A، Fried D، Nakash I، Hanukoglu I (نوفمبر 1995). "Selective increases in adrenal steroidogenic capacity during acute respiratory disease in infants". European Journal of Endocrinology. ج. 133 ع. 5: 552–556. DOI:10.1530/eje.0.1330552. PMID:7581984. S2CID:44439040.
- ^ Bhangoo A، Anhalt H، Ten S، King SR (مارس 2006). "Phenotypic variations in lipoid congenital adrenal hyperplasia". Pediatric Endocrinology Reviews. ج. 3 ع. 3: 258–271. PMID:16639391.
- ^ al Kandari H، Katsumata N، Alexander S، Rasoul MA (أغسطس 2006). "Homozygous mutation of P450 side-chain cleavage enzyme gene (CYP11A1) in 46, XY patient with adrenal insufficiency, complete sex reversal, and agenesis of corpus callosum". The Journal of Clinical Endocrinology and Metabolism. ج. 91 ع. 8: 2821–2826. DOI:10.1210/jc.2005-2230. PMID:16705068.
- ^ Kim CJ، Lin L، Huang N، Quigley CA، AvRuskin TW، Achermann JC، Miller WL (مارس 2008). "Severe combined adrenal and gonadal deficiency caused by novel mutations in the cholesterol side chain cleavage enzyme, P450scc". The Journal of Clinical Endocrinology and Metabolism. ج. 93 ع. 3: 696–702. DOI:10.1210/jc.2007-2330. PMC:2266942. PMID:18182448.
- ^ FBuonocore F، Achermann JC (2020). "Primary adrenal insufficiency: New genetic causes and their long-term consequences". Clinical Endocrinology. ج. 92 ع. 1: 11–20. DOI:10.1111/cen.14109. PMC:6916405. PMID:31610036.
- ^ Becker KL (2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. ص. 735–. ISBN:978-0-7817-1750-2. مؤرشف من الأصل في 2022-09-27.
- ^ Jameson JL، De Groot LJ (18 مايو 2010). Endocrinology - E-Book: Adult and Pediatric. Elsevier Health Sciences. ص. 301–302. ISBN:978-1-4557-1126-0. مؤرشف من الأصل في 2022-09-29.
- ^ Ortiz de Montellano PR (13 مارس 2015). Cytochrome P450: Structure, Mechanism, and Biochemistry. Springer. ص. 851–879. ISBN:978-3-319-12108-6. مؤرشف من الأصل في 2022-09-27.
قراءة إضافية
[عدل]- Helmberg A (أغسطس 1993). "Twin genes and endocrine disease: CYP21 and CYP11B genes". Acta Endocrinologica. ج. 129 ع. 2: 97–108. DOI:10.1530/acta.0.1290097. PMID:8372604.
- Papadopoulos V، Amri H، Boujrad N، Cascio C، Culty M، Garnier M، وآخرون (يناير 1997). "Peripheral benzodiazepine receptor in cholesterol transport and steroidogenesis". Steroids. ج. 62 ع. 1: 21–28. DOI:10.1016/S0039-128X(96)00154-7. PMID:9029710. S2CID:1977513.
- Stocco DM (يونيو 2000). "Intramitochondrial cholesterol transfer". Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. ج. 1486 ع. 1: 184–197. DOI:10.1016/S1388-1981(00)00056-1. PMID:10856721.
- Kristensen VN، Kure EH، Erikstein B، Harada N، Børresen-Dale A (أكتوبر 2001). "Genetic susceptibility and environmental estrogen-like compounds". Mutation Research. ج. 482 ع. 1–2: 77–82. DOI:10.1016/S0027-5107(01)00212-3. PMID:11535251.
- Strauss JF (نوفمبر 2003). "Some new thoughts on the pathophysiology and genetics of polycystic ovary syndrome". Annals of the New York Academy of Sciences. ج. 997 ع. 1: 42–48. Bibcode:2003NYASA.997...42S. DOI:10.1196/annals.1290.005. PMID:14644808. S2CID:23559461.
- Wada A، Waterman MR (نوفمبر 1992). "Identification by site-directed mutagenesis of two lysine residues in cholesterol side chain cleavage cytochrome P450 that are essential for adrenodoxin binding". The Journal of Biological Chemistry. ج. 267 ع. 32: 22877–22882. DOI:10.1016/S0021-9258(18)50028-4. PMID:1429635.
- Hu MC، Guo IC، Lin JH، Chung BC (مارس 1991). "Regulated expression of cytochrome P-450scc (cholesterol-side-chain cleavage enzyme) in cultured cell lines detected by antibody against bacterially expressed human protein". The Biochemical Journal. ج. 274 ع. Pt 3: 813–817. DOI:10.1042/bj2740813. PMC:1149983. PMID:1849407.
- Sparkes RS، Klisak I، Miller WL (يونيو 1991). "Regional mapping of genes encoding human steroidogenic enzymes: P450scc to 15q23-q24, adrenodoxin to 11q22; adrenodoxin reductase to 17q24-q25; and P450c17 to 10q24-q25". DNA and Cell Biology. ج. 10 ع. 5: 359–365. DOI:10.1089/dna.1991.10.359. PMID:1863359.
- Coghlan VM، Vickery LE (أكتوبر 1991). "Site-specific mutations in human ferredoxin that affect binding to ferredoxin reductase and cytochrome P450scc". The Journal of Biological Chemistry. ج. 266 ع. 28: 18606–18612. DOI:10.1016/S0021-9258(18)55106-1. PMID:1917982.
- Matteson KJ، Chung BC، Urdea MS، Miller WL (أبريل 1986). "Study of cholesterol side-chain cleavage (20,22 desmolase) deficiency causing congenital lipoid adrenal hyperplasia using bovine-sequence P450scc oligodeoxyribonucleotide probes". Endocrinology. ج. 118 ع. 4: 1296–1305. DOI:10.1210/endo-118-4-1296. PMID:2419119.
- Chung BC، Matteson KJ، Voutilainen R، Mohandas TK، Miller WL (ديسمبر 1986). "Human cholesterol side-chain cleavage enzyme, P450scc: cDNA cloning, assignment of the gene to chromosome 15, and expression in the placenta". Proceedings of the National Academy of Sciences of the United States of America. ج. 83 ع. 23: 8962–8966. Bibcode:1986PNAS...83.8962C. DOI:10.1073/pnas.83.23.8962. PMC:387054. PMID:3024157.
- Morohashi K، Sogawa K، Omura T، Fujii-Kuriyama Y (أبريل 1987). "Gene structure of human cytochrome P-450(SCC), cholesterol desmolase". Journal of Biochemistry. ج. 101 ع. 4: 879–887. DOI:10.1093/oxfordjournals.jbchem.a121955. PMID:3038854.
- Maruyama K، Sugano S (يناير 1994). "Oligo-capping: a simple method to replace the cap structure of eukaryotic mRNAs with oligoribonucleotides". Gene. ج. 138 ع. 1–2: 171–174. DOI:10.1016/0378-1119(94)90802-8. PMID:8125298.
- Gharani N، Waterworth DM، Batty S، White D، Gilling-Smith C، Conway GS، وآخرون (مارس 1997). "Association of the steroid synthesis gene CYP11a with polycystic ovary syndrome and hyperandrogenism". Human Molecular Genetics. ج. 6 ع. 3: 397–402. DOI:10.1093/hmg/6.3.397. PMID:9147642.
- Suzuki Y، Yoshitomo-Nakagawa K، Maruyama K، Suyama A، Sugano S (أكتوبر 1997). "Construction and characterization of a full length-enriched and a 5'-end-enriched cDNA library". Gene. ج. 200 ع. 1–2: 149–156. DOI:10.1016/S0378-1119(97)00411-3. PMID:9373149.
- Hukkanen J، Mäntylä M، Kangas L، Wirta P، Hakkola J، Paakki P، وآخرون (فبراير 1998). "Expression of cytochrome P450 genes encoding enzymes active in the metabolism of tamoxifen in human uterine endometrium". Pharmacology & Toxicology. ج. 82 ع. 2: 93–97. DOI:10.1111/j.1600-0773.1998.tb01404.x. PMID:9498238.
- Zhou Z، Shackleton CH، Pahwa S، White PC، Speiser PW (مارس 1998). "Prominent sex steroid metabolism in human lymphocytes". Molecular and Cellular Endocrinology. ج. 138 ع. 1–2: 61–69. DOI:10.1016/S0303-7207(98)00052-5. PMID:9685215. S2CID:20490901.
تخليق الهرمونات الستيرويدية
[عدل]

صور إضافية
[عدل]روابط خارجية
[عدل]- Cytochrome+P450scc في المكتبة الوطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).