حمض ثنائي الثيونوز
| حمض ثنائي الثيونوز | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
Dithionous acid |
|
| أسماء أخرى | |
Hydrosulfurous acid |
|
| المعرفات | |
| CAS | 15959-26-9 |
| بوب كيم | 24490[1] |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | H2S2O4 |
| الكتلة المولية | 130.14 غ/مول |
| حموضة (pKa) | 0.35 2.45 [3] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
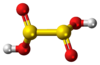
حمض ثنائي الثيونوز هو حمض أكسجيني مضاعف الكبريت صيغته H2S2O4، وهو غير مستقر؛[4] لكن أملاحه التي تدعى ثنائي ثيونيت معروفة ومستقرة، ولا يمكن إجراء عملية استحصال الحمض منها.
الخواص
[عدل]بينت حسابات «منذ البدء» النظرية أن البنية المتناظرة من النمط C2 حيث يكون الجزيء على الشكل HOS(=O)-S(=O)OH هي أكثر بنية مستقرة بين المتصاوغات.[4] يعود سبب ذلك إلى وجود الروابط الهيدروجينية بين الجزيئية.
بالرغم من ذلك، فإن هذا المركب غير مستقر كيميائياً ويتفكك إلى ثنائي أكسيد الكبريت SO2 وحمض الهيبوكبريتوز.S(OH)2
الأملاح
[عدل]
تعد أملاح هذا الحمض أكثر استقراراً؛ إذ أن ثنائي الثيونيت هو أنيون أكسجيني للكبريت،[5] صيغته −2S2O4.
تخضع هذه الأنيونات إلى تفاعل أكسدة-اختزال حيث يتشكل أنيون الكبريتيت، حيث تبلغ قيمة جهد الاختزال مقدار −0.66 فولت:[6]
ومن الأمثلة عليها ثنائي ثيونيت الصوديوم، وهو يوجد على شكل مسحوق أبيض وله خواص مختزلة ويستخدم في عمليات التبييض الصناعية.
طالع أيضاً
[عدل]مراجع
[عدل]- ^ ا ب ج د dithionous acid (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Catherine E. Housecroft؛ Alan G. Sharpe (2008). "Chapter 16: The group 16 elements". Inorganic Chemistry, 3rd Edition. Pearson. ص. 520. ISBN:978-0-13-175553-6.
- ^ ا ب Drozdova، Yana؛ Steudel، Ralf؛ Hertwig، Roland H.؛ Koch، Wolfram؛ Steiger، Thomas (1998). "Structures and Energies of Various Isomers of Dithionous Acid, H2S2O4, and of Its Anion HS2O4- 1". The Journal of Physical Chemistry A. ج. 102 ع. 6: 990–996. Bibcode:1998JPCA..102..990D. DOI:10.1021/jp972658d.
- ^ International Union of Pure and Applied Chemistry (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): Royal Society of Chemistry–International Union of Pure and Applied Chemistry (IUPAC). (ردمك 0-85404-438-8). p. 130. نسخة إلكترونية باللغة الإنجليزية.
- ^ Mayhew, S. G. (2008). "The Redox Potential of Dithionite and SO2− from Equilibrium Reactions with Flavodoxins, Methyl Viologen and Hydrogen plus Hydrogenase". European Journal of Biochemistry. ج. 85: 535–547. DOI:10.1111/j.1432-1033.1978.tb12269.x.

