كاليوترون

الكاليوترون (بالإنجليزية: calutron) هو مطياف كتلة يستخدم لفصل نظائر اليورانيوم. تم تطويره من قبل إرنست أورلاندو لورنس[1] أثناء قيام مشروع مانهاتن، حيث يبدو مثل سيكاوترون الذي اخترعة في وقت سابق. ممصطلح كاليوترون هو اختصار للكلمة العبارة الإنجليزية Cal.U.-tron (اختصار ل California University-tron) أو ترون-جامعة كاليفورنيا، تيمنا باسم جامعة كاليفورنيا، حيث يعمل إرنست لورانس، الذي يشرف مختبر لوس ألاموس الوطني.[2] استخدم الكالترون حينها على نطاق صناعي لتخصيب اليورانيوم في مجمع الأمن القومي Y-12 الواقع في أوك ريدج، بالقرب من مختبر أوك ردج الوطني. من هذا المركب، جاء معظم اليورانيوم الذي استخدم في صنع قنبلة الولد الصغير الذرية على هيروشيما في سنة 1945.
الكاليوترون هو نوع من مطياف الكتلة القطاعي، يستخدم عملية تأين العينات ثم تسريعها بواسطة الحقول الكهربائية وحرفها بواسطة المجالات المغناطيسية، لتصطدم الأيونات في النهاية بلوحة وتنتج تيارا كهربائيا يمكن قياسه. نظرًا لأن أيونات النظائر المختلفة لها نفس الشحنة الكهربائية ولكن كتلتها مختلفة، تنحرف النظائر الثقيلة تحت تأثير المجال المغناطيسي بدرجة أقل، نتيجة لذلك ينفصل شعاع الجسيمات إلى عدة حزم حسب الكتلة، لتصطدم باللوحة في مواقع مختلفة. يمكن حساب كتلة الأيونات تبعا لقوة المجال وشحنة الأيونات. خلال الحرب العالمية الثانية، تم تطوير الكاليوترونات خصيصا لاستخدام هذا المبدأ بغية الحصول على كميات كبيرة من اليورانيوم 235 عالي النقاء، من خلال الاستفادة من فرق الكتلة الصغير بين نظائر اليورانيوم. تم التخلي عن عملية الفصل الكهرومغناطيسي لتخصيب اليورانيوم خلال فترة ما بعد الحرب وتم استبدالها بطريقة الانتشار الغازي الأكثر تعقيدا والأكثر كفاءة.
مبدأ العمل
[عدل]نظائر اليورانيوم المختلفة
[عدل]تُعرَّف النظائر على أنها نويدات من نفس العنصر الكيميائي، حيث يكمن الفرق الوحيد بينها في عدد النيوترونات التي يحتويها كل نظير. بالإضافة إلى ذلك، تتميز النظائر المختلفة لعنصر ما بعدد كتلي مختلف (مجموع بروتوناتها ونيوتروناتها)، فضلاً عن وفرتها النسبية، أي نسبة تواجدها مقارنة بالنظائر الأخرى لنفس العنصر المعني.[3] لليورانيوم ثلاثة نظائر هي: اليورانيوم 238 و235 و234. يوجد اليورانيوم 234 بكميات صغيرة لدرجة أنه لا يكاد يذكر مع هذه النظائر.[4] بالإضافة إلى ذلك، يتكون كل من النظيرين المتبقيين 92 بروتونا، لكن أحدهما (اليورانيوم 238) يحتوي على 146 نيوترونا وله وفرة نسبية تبلغ 99.3 في المائة، بينما الآخر (اليورانيوم 235) فيحتوي على 143 نيوترونا فقط ووفرة نسبية 0.7 في المائة. هذا الاختلاف الحاصل بين عدد النيوترونات في أنوية النظائر المختلفة يعطيها لكل منها كتلة مختلفة، حيث يتم استغلال هذا المعطى في عملية فصلها.[5]
مبدأ عمل الفصل الكهرومغناطيسي
[عدل]الحرف (المجال المغناطيسي)
[عدل]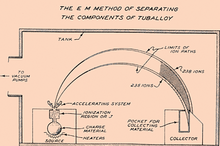

فعليا في سنة 1913 وقبل وقت طويل من اندلاع الحرب العالمية الثانية، لاحظ الفيزيائي جوزيف جون طومسون أنه إذا تم تسريع جسيم كتلته m وشحنته z بسرعة معينة داخل مجال مغناطيسي B، فإن هذا الجسيم يتبنى مسارا دائريا منتظما نصف قطره r يتناسب مع كتلة الجسيم:[6]
لذلك في ظل هذه الظروف وعلى اعتبار أن اليورانيوم 235 يعتبر أخف من الاثنين، فإنه يتخذ مسارًا بمنحنى أقل وضوحًا، وبنصف قطر أصغر من اليورانيوم 238، مما يجعل عملية فصلهما ممكنة. توضح الوثيقة 2 بطريقة مبسطة كيفية فصل النظائر المختلفة وفقا لنسبة الكتلة على الشحنة (m/z) بعد خضوعها لعمليتي التبخير والتأين. الكاليوترون هو مجرد مطياف الكتلة تم التعديل عليه لأداء نفس المهمة على أكمل وجه، حيث أن دقته تعد أعلى بكثير من نماذج مطياف الكتلة الأولية.
التسريع (المجال الكهربائي)
[عدل]من أجل حرف وفصل نظائر اليورانيوم 235 و 238 بشكل أوفر باستخدام مجال مغناطيسي، يجب أولا تسريع أيونات هذه النظائر للوصول إلى سرعة ملموسة. يعود الفضل في ذلك بشكل خاص إلى العمل الذي قام به الفيزيائي الأيرلندي إيرنست والتون ومساعديه خلال أوائل سنوات الثلاثينيات؛ ابتكروا أول مسرع للجسيمات يسمح بالانشطار النووي لليثيوم، حيث كان إرنست لورنس قادرا على تسريع الأيونات في جهاز الكاليوترون الذي ابتكره. في الواقع يتم ذلك وفق مبدأ عمل بسيط. من خلال تطبيق فرق الجهد بين قطبين كهربائيين، فإن الجسيم المشحون مثل أيون اليورانيوم على سبيل المثال، يكتسب طاقة حركية ليمر بينها وبالتالي يتم تسريعة.يتم ذلك وفق المعادلة الرياضة التالية:[7]
بحيث:
- q هي الشحنة بالكولوم،
- V فرق الجهد بالفولت،
- m الكتلة بالكيلوغرام،
- v السرعة باالمتر لكل الثانية.
اليورانيوم الموجود بشكل طبيعي في القشرة الأرضية لا يكون بالطبع على شكل أيوني. لذلك من الضروري تأينه من أجل دخوله في عملية الفصل الكهرومغناطيسي للفصل بينا النظائر المختلفة. بالإضافة إلى ذلك، ولتسهيل نقل الأيونات على طول المسار، يجب أولا تبخير اليورانيوم.
التبخير
[عدل]يوجد اليورانيوم بشكل شائع في قشرة الأرض على شكل أكاسيد ذات حالة أكسدة تتراوح بين 2+ و6+، على الرغم من أن حالات الأكسدة 4+ و6+ هي الوحيدة التي تعتبر مستقرة. يتغير أي مركب إلى الحالة الغازية عند تسخينه في ظل درجة حرارة معينة. لسوء الحظ، تبلغ درجة غليان اليورانيوم المعدني 4093 كلفن. لذلك تتطلب عملية التبخير المستخدمة في الكاليوترون استخدام ملح اليورانيوم ذي نقطة الغليان المنخفضة. تم اختبار عدد من أملاح اليورانيوم خلال قيام مشروع مانهاتن، مثل رباعي كلوريد اليورانيوم (UCl4) ذي درجة حرارة تبخير تبلغ حوالي 873 كلفن وأيضا سداسي فلوريد اليورانيوم (UF6) الذي يمتلك درجة حرارة تبخير تعادل 329 كلفن. تجدر الإشارة هنا إلى أن ملح سداسي فلوريد اليورانيوم لديه ميزة واضحة عن باقي الأملاح الأخرى، حيث أن الفلور يكونو أحادي النظير، في حين أن الكلور والبروم ليسوا كذلك. في المقابل، جاء معظم اليورانيوم المستخدم خلال مشروع مانهاتن من رباعي كلوريد اليورانيوم.[8]
التأيين
[عدل]بمجرد تبخيره وتحويله إلى الحالة الغازية، يجب تأيين اليورانيوم. لهذا الغرض، يتم استخدام خيطين من التنتالوم. عندما يجري تسخين خيوط معدنية (مثل خيوط التنتالوم والتنغستن) إلى درجات حرارة عالية جدًا، فإن إلكتروناتها ستستثار، وستنبعث منها طاقة عالية. عندما تصطدم هذه الأخيرة باليورانيوم المتبخر فإنه سيتأين إلى U+ وCl- وF-.[8]
بعد عملية التأين، تمر الأيونات الناتجة عبر شق لتشكيل حزمة أيونية يجري تسريعها بواسطة تيار كهربائي ومن ثمة يتم تعريضها لمجال مغناطيسي لكي تنحرف.
أهمية الفراغ
[عدل]من المهم أن التنويه أن جميع العمليات التي يجري تنفيدها باستعمال الكاليوترون يجب أن تتم في فراغ مرتفع نسبيًا (من 10−5 إلى 10 −8 تور)، حيث أن وجود جزيئات أخرى في الهواء من شأنه التأثير سلبا على عملية التأين وكذا المسار الذي ستقطعه جزيئات اليورانيوم.
انظر أيضًا
[عدل]مراجع
[عدل]- ^ Lawrence Berkeley Lab, ed. (1981). "Lawrence and His Laborator". LBL Newsmagazine (بالإنجليزية). Archived from the original on 2021-01-15. Retrieved 2021-02-01.
- ^ بي دي إف (بالإنجليزية) William E. Parkins, « The Uranium Bomb, the Calutron, and the Space-Charge Problem », في Physics Today, vol. 58, no 5, 2005-05-01, ص. 45–51 [النص الكامل, lien DOI (pages consultées le 2021-02-01)] نسخة محفوظة 28 يناير 2012 على موقع واي باك مشين. "نسخة مؤرشفة". مؤرشف من الأصل في 2012-01-28. اطلع عليه بتاريخ 2021-02-02."نسخة مؤرشفة". مؤرشف من الأصل في 2012-01-28. اطلع عليه بتاريخ 2021-02-02.
- ^ Rusconi F. (2011). Manuel de spectrométrie de masse à l’usage des biochimistes (بالفرنسية). Paris, France: Lavoisier. p. 644.
- ^ "Canadian soil quality guidelines for the protection of environmental and human health: Uranium". Canadian Council of Ministers of the Environment. 2007. مؤرشف من الأصل في 2020-06-27. اطلع عليه بتاريخ 12/3/2016.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ Muller R.A. (2008). Physics for Future Presidents: The science behind the Headlines (بالإنجليزية). New York, États-Unis: W.W. Norton & Company. p. 384.
- ^ Thomson J.J.Catégorie:Utilisation du paramètre auteur dans le modèle article, « Ray of Positive Electricity », في Proceedings of the Royal Society 1(89): 1-20, 1913
- ^ Seidel R.W. (2015). Cockcroft and Walton Split the Atom (بالإنجليزية). Ipswich, États-Unis: Salem Press Encyclopedia. p. 3.
- ^ ا ب Yergey A. L., Yergey K. A.Catégorie:Utilisation du paramètre auteur dans le modèle article, « Preparative Scale Mass Spectrometry: A Brief History of the Calutron », في Journal of the American Society for Mass Spectrometry 8(9): 943-953, 1997


