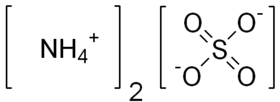كبريتات الأمونيوم
المظهر
| كبريتات الأمونيوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
كبريتات الأمونيوم |
|
| أسماء أخرى | |
كبريتات ثنائية الأمونيوم |
|
| المعرفات | |
| رقم CAS | 7783-20-2 |
| بوب كيم | 24538[1]، و6097028 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | NH4)2SO4) |
| الكتلة المولية | 132.14 غ/مول |
| المظهر | بلورات عديمة اللون |
| الكثافة | 1.77 غ/سم3 |
| نقطة الانصهار | 280 °س يتفكك |
| الذوبانية في الماء | 73 غ/100 مل ماء عند 20 °س |
| الذوبانية | لا ينحل في المحلات العضوية |
| المخاطر | |
| توصيف المخاطر | - |
| تحذيرات وقائية | - |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
كبريتات الأمونيوم[3] هو مركب كيميائي له الصيغة المجملة H8N2O4S ، والصيغة المفصلة له NH4)2SO4)، ويكون على شكل بلورات عديمة اللون. تتميز بلورات مركب كبريتات الأمونيوم أنها غير قابلة للاسترطاب ، ولا تتكتل على بعضها البعض.
الخواص
[عدل]- ينحل مركب كبريتات الأمونيوم بشكل جيد في الماء.
- تتفاعل المحاليل المائية لمركب كبريتات الأمونيوم بشكل حمضي ضعيف.
- لا ينحل مركب كبريتات الأمونيوم في المحلات العضوية.
- بالتسخين يتفكك مركب كبريتات الأمونيوم إلى بيكبريتات الأمونيوم محرراً الأمونياك.
التحضير
[عدل]يحضر مركب كبريتات الأمونيوم من تمرير غاز الأمونياك في حمض الكبريتيك ، ثم بتبخير حذر للمحلول الناتج.
H2SO4 + 2NH3 → (NH4)2SO4
مع الإشارة إلى أن التفاعل ناشر للحرارة بشكل كبير جدا.
أو بتفاعل الحديد مع حمض الكبريتيك المركز طبقا للتفاعل الأتي [4]
2Fe + 6H2SO4 → Fe2(SO4)3 + 6H2O + 3SO2
من ثمة تفاعل الناتج مع هيدروكسيد الأمونيوم طبقا للتفاعل الأتي [5][6]
Fe2(SO4)3 + 6 NH4OH → 2 Fe(OH)3 + 3 (NH4)2SO4
الاستخدامات
[عدل]- يستخدم مركب كبريتات الأمونيوم في مجال الأسمدة.
- يستخدم المركب أيضاً في مجال التجهيز ضد الحرائق.
- يعد مصدراً للنيتروجين في محاليل التغذية الخاصة بتكثير الخميرة.
المصادر
[عدل]- ^ ا ب ج sulfuric acid diamine (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ قاموس مصطلحات الفلاحة (بالعربية والفرنسية). الجزائر العاصمة: المجلس الأعلى للغة العربية بالجزائر. 2018. ص. 27. ISBN:978-9931-681-42-7. OCLC:1100055505. QID:Q121071043.
- ^ "Fe + H2SO4 = Fe2(SO4)3 + H2O + SO2 - موازن المعادلات الكيميلئية". ChemicalAid. مؤرشف من الأصل في 2021-03-05. اطلع عليه بتاريخ 2021-03-05.
- ^ "Fe2(SO4)3 + NH4OH = Fe(OH)3 + (NH4)2SO4 - موازن المعادلات الكيميلئية". ChemicalAid. مؤرشف من الأصل في 2021-03-05. اطلع عليه بتاريخ 2021-03-05.
- ^ "Chemical Equations online!". chemequations.com. مؤرشف من الأصل في 2021-03-05. اطلع عليه بتاريخ 2021-03-05.
- Taschenbuch chemische Substanzen, Willmes, Verlag Harri Deutsch, ISBN 3-8171-1662-4
في كومنز صور وملفات عن Ammonium sulfate.