أسيتون
| أسيتون[1] | |
|---|---|
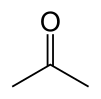 |
 |
 |
 |
| الاسم النظامي (IUPAC) | |
Acetone or Propanone |
|
| تسمية الاتحاد الدولي للكيمياء | |
propan-2-one[2] |
|
| أسماء أخرى | |
| المعرفات | |
| الاختصارات | DMK |
| رقم التسجيل (CAS) | 67-64-1 |
| بب كيم (PubChem) | 180 |
|
|
| الخواص | |
| صيغة كيميائية | C3H6O |
| كتلة مولية | 58.08 غ.مول−1 |
| المظهر | سائل عديم اللون |
| الرائحة | زهرية، مهيّجة، حادة |
| الكثافة | 0.791 غم·سم−3 |
| نقطة الانصهار | -275 °س، 178 - 180 °ك، -463 °ف |
| نقطة الغليان | -274 °س، 329 - 330 °ك، -461 °ف |
| الذوبانية في الماء | قابل للإمتزاج |
| الذوبانية | قابل للإمتزاج في بنزين (مركب كيميائي)، ثنائي إيثيل الإيثر، ميثانول، كلوروفورم، إيثانول[8] |
| log P | −0.042 |
| ضغط البخار | 9.39 كيلو باسكال (0 °س) 30.6 كيلو باسكال (25 °س) 374 كيلو باسكال (100 °س) 2.8 ميغا باسكال (200 °س)[9] |
| حموضة (pKa) | 19.2 |
| القاعدية (pKb) | −5.2 (في حالة القاعدة المترافقة) |
| معامل الانكسار (nD) | 1.359 |
| اللزوجة | 0.36 (10 °س) 0.295 (25 °س)[8] سنتيبواز |
| البنية | |
| التنسيق الهندسي | مستوي ثلاثي عند C2 |
| البنية الجزيئية | ثنائي السطوح عند C2 |
| عزم جزيئي ثنائي القطب | 2.91 ديباي |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
(-250.03) − (-248.77) كيلوجول·مول−1 |
| تغير الإنتالبي القياسي للاحتراق ΔcH |
-1.772 ميغاجول·مول−1 |
| إنتروبيا مولية قياسية S |
200.4 جول·مول−1·ك |
| الحرارة النوعية، C | 125.45 جول·مول−1·ك |
| المخاطر | |
| رمز الخطر وفق GHS |   |
| وصف الخطر وفق GHS | DANGER |
| بيانات الخطر وفق GHS | H225, H319, H336 |
| بيانات وقائية وفق GHS | P210, P261, P305+351+338 |
| فهرس المفوضية الأوروبية | 606-001-00-8 |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| NFPA 704 |
|
| حدود الاشتعال | 2.6–12.8%[10] |
| حد التعرض المسموح به U.S | 1000 جزء في المليون (2400 مغ/م3)[7] |
| 1185 مغ/م3 (TWA) 2375 مغ/م3 (STEL) |
|
| LD50 | 5800 مغ/كغم (جرذ, فموي) 3000 مغ/كغم (فأر, فموي) 5340 مغ/كغم (أرنب, فموي)[11] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
الأسيتون[12][13][14] (التسمية النظامية: 2-بروبانون) هو مركب كيميائي عضوي صيغته الكيميائية CH3COCH3 ويتبع لعائلة الكيتونات ويعدّ أبسط ممثل لهذه العائلة. الأسيتون سائل عديم اللون قابل للاشتعال ودرجة انصهاره −95.4 °C ودرجة غليانه 56.53 °C. يعدّ استخدامه كمزيل لطلاء الأظافر من أشهر الاستخدامات المنزلية. كما يستخدم الأسيتون في صناعة اللدائن، الألياف، الأدوية وكيماويات أخرى. يذوب الأسيتون في المياه والكحول والإيثر. ويعدّ الأسيتون مذيباً عضوياً هاماً. وعادة ما يُعتبر المذيب المفضل لأغراض التنظيف في المختبر. وأُنتج نحو 5.1 مليون طن سنوياً في جميع أنحاء العالم في عام 2009، للاستخدام بشكل رئيس كمذيب وفي إنتاج ميثيل ميثاكريلات وثنائي الفينول أ.[15][16] وتتمثل الاستخدامات المنزلية المعروفة للأسيتون في قيامه بدور العنصر النشط في إزالة طلاء الأظافر وكمرقق للطلاء. كما يعدّ وحدة بناء معتادة في الكيمياء العضوية. يتم إنتاج الإسيتون بشكل طبيعي داخل جسم الإنسان ويتم التخلص منه أيضاً كنتيجة لعمليات التمثيل الغذائي الطبيعية وقد أظهرت اختبارات السمية الإنجابية أن الأسيتون لدية قدرة ضئيلة على تسبيب مشاكل الإنجاب وفي الواقع يقوم الجسم طبيعياً بزيادة مستوى الأسيتون في النساء الحوامل والأمهات المرضعة والأطفال لأن احتياجهم العالي أو المرتفع للطاقة يؤدي إلى إنتاج الأسيتون بمعدلات أعلى ويقوم المجتمع الطبي الآن باستخدام الحمية الكيتونية والتي تزيد من الأسيتون داخل الجسم للحد من هجمات أو نوبات الصرع عند الرضع والأطفال الذين يعانون من حالات الصرع المستعصية المُرتدّة. (بحاجة لمصدر)
الإنتاج
[عدل]يتم إنتاج الأسيتون بشكل مباشر أو غير مباشر من البروبيلين. عادة، في عملية الكيومين، حيث يتمّ ألكلة البنزين باستخدام البروبين وينتج الكيومين (ايزوبروبيل بنزين) وبعد ذلك يتم أكسدة الكيومين لإعطاء الفينول والأسيتون.
C6H5CH(CH3)2 + O2 → C6H5OH + (CH3)2CO
ويقتضي هذا التفاعل تكون الوسيط هيدروبيروكسيد كيومين C6H5C(OOH)(CH3)2
طرق الإنتاج قديماً
[عدل]يُنتج الأسيتون سابقاً عن طريق التقطير الجاف للأسيتات على سبيل المثال أسيتات الكالسيوم Ca(CH3COO)2. أثناء الحرب العالمية الأولى تم إنتاج الأسيتون من خلال التخمر البكتيري حيث تم تطويره وإنتاجه بواسطة حاييم وايزمان (أول رئيس لإسرائيل) للمساعدة في المجهود الحربي البريطاني.[15] وقد تمّ التخلي عن عملية الأسيتون بيوتانول إيثانول بسبب ضآلة الناتج.[15]
البناء أو التخليق الحيوي
[عدل]انظر أيضاً : الكيتونية
يتمّ إنتاج كميات قليلة من الأسيتون داخل الجسم عن طريق نزع الكربوكسيل من المركبات الكيتونية.
الاستخدامات
[عدل]يتم استهلاك نصف إنتاج العالم تقريباً من الأسيتون على هيئة ممهدات لميثيل ميثا أكريليت.[16] ويبدأ هذا التطبيق مع التحويل الأولي للأسيتون إلى السيانوهيدرين:
CO(CH3)2 + HCN → (CH3)2C(OH)CN
وفي خطوة لاحقة، يتم تحليل النتريل إلى أميد غير مشبع حيث يتم أسترته كالتالي :
CN(OH)C(CH3)2 + CH3OH → CH2=(CH3)CCO2CH3 + NH3
الاستخدام الرئيسي الثاني للأسيتون يستلزم تكثيفه باستخدام الفينول لكي يعطي ثنائي الفينول أ :
CO(CH3)2 + 2 C6H5OH → (CH3)2C(C6H4OH)2 + H2O
ثنائي فينول أ هو مكون لبوليمرات عديدة مثل بولي كاربونات، بولي يوريثان، وراتنجات الإيبوكسي.
استخدام الأسيتون كمذيب
[عدل]الأسيتون هو مذيب جيد لمعظم المواد البلاستيكية والألياف الصناعية بما في ذلك تلك المستخدمة في الزجاجات المعملية المصنوعه من البوليسترين والبولي كربونات وبعض الأنواع من مادة البولي بروبيلين.[17] ويعدّ مثالي لتخفيف راتنجات الألياف الزجاجية وفي تنظيف أدوات الألياف الزجاجية وإزابة جزئين الإيبوكسي والغراء القوي قبل التصلب كما أنه يستخدم كعنصر متطاير لبعض الدهانات والورنيش كما أنه يعدّ مفيد في إعداد أو تجهيز المعدن قبل دهنه بل وأيضا يستخدم في تخفيف راتنجات البوليستر والفينيل والمواد اللاصقة.
ويتم استهلاك ملايين الكيلوجرامات من الأسيتون في إنتاج المذيبات : كحول الأيزوبيوتيل الميثيل وكيتون الأيزوبيوتيل الميثيل.وتنشأ هذه المنتجات عن طريق تكثيف أولى للألدول لإعطاء كحول الداي أسيتون.[16]
2CO(CH3)2 → (CH3)2C(OH)CH2C(O)CH3
يستخدم الأسيتون كمذيب في الصناعات الدوائية ويستخدم كعامل نزع للبروتين أو للتمسخ في الكحولات المتمسخة أو المغايرة للطبيعة.[17] كما يستخدم الأسيتون أيضا كسواغ في بعض المنتجات الدوائية.
تخزين الأسيتيلين
[عدل]على الرغم من أن الأسيتون قابل للاشتعال من تلقاء نفسه إلا أنه يستخدم على نطاق واسع كمذيب للنقل والتخزين الآمن للأستيلين والذي لا يمكن تعريضه للضغط بأمان كمركب نقي.تمتلئ أولا الأوعية المحتوية على مادة مسامية بالأسيتون يليه الأستيلين والذي يذوب في الأسيتون.واحد لتر من الأسيتون يمكنه إذابة حوالي (250) لتر من الأسيتيلين.[18][19]
الاستخدامات الطبية والتجميلية
[عدل]يستخدم الأسيتون في مجموعة متنوعة من التطبيقات الطبية العامة والتجميلية كما أنه مدرج أيضا كعنصر من المضافات الغذائية والتغليف الغذائي. ويشيع استخدام الأسيتون في عملية تجديد شباب الجلد في المكاتب والمنتجعات الطبية. منذ أيام مصر القديمة، كان الناس يستخدمون طرق التقشير الكيميائي لتجديد شباب الجلد.وهناك بعض العوامل الشائعة المستخدمة اليوم لعملية التقشير الكيميائي وهو حمض الساليسيلك وحمض الجليكوليك وأيضا (30%) من حمض الساليسيلك في الكحول الإيثيلي وحمض الخليك ثلاثي الكلور (كلوروفورم الميثيل).قبل التقشير الكيميائي، يجب أن تنظف البشرة بشكل صحيح ويجب إزالة الدهون الزائدة.وتعرف هذه العملية بنزع أو التخلص من الدهون ويستخدم في هذه العملية الأسيتون أو السبتيسول أو مزيج من هذه العوامل بشكل شائع.
الاستخدامات المعملية
[عدل]في المختبر يستخدم الأسيتون كمذيب قطبي لا بروتوني في مجموعه متنوعه من التفاعلات العضوية مثل تفاعلات (SN2).ويعدّ استخدام مذيب الأسيتون أمر بالغ الأهمية للأكسدة جونز. وهو أيضا مذيب شائع لشطف زجاجيات المختبر بسبب تكلفته المنخفضة وتطايره ومع ذلك فإنه لا يشكل آزوتروب مع الماء.[20] وعلى الرغم من استخدامه الشائع كعامل تجفيف مفترض، إلا أنه لا يعدّ فعال إلا بإزاحة التراكم وتخفيفه.ويمكن تبريد الأسيتون باستخدام الثلج الجاف إلى (-78درجة سيلوزية)دون تجميده ويشيع استخدام حمامات الأسيتون بالثلج الجاف لإجراء التفاعلات في درجات الحرارة المنخفضة ويعطي الأسيتون ضي أو إشعاعا فلوري تحت الأشعة الفوق بنفسجية ويمكن أن يستخدم بخاره ككواشف مشعه في تجارب تدفق السوائل.[20]
الاستخدامات المنزلية والاستخدامات المتخصصة الأخرى
[عدل]غالبا ما يكون الأسيتون المكون الأساسي للعوامل المنظفة مثلا يستخدم كمزيل لطلاء الأظافر. خلات الإيثيل وهو مذيب آخر عضوي يمكن استخدامه أيضا أحيانا.والأسيتون هو مكون من مزيل الغراء القوي كما أنه يزيل بسهولة الترسيبات من على الزجاج والخزف أو البورسيلين. يمكن استخدام الأسيتون أيضا كعامل فني أو تجميلي وذلك عندما يفرك على الجزء الخلفي من طباعة ليزر أو عند وضع صورة ضوئية بحيث يكون وجهها لأسفل على سطح آخر وتصقل أو تلمع بشدة وبذلك ينتقل حبر الصورة إلى سطح الوجهة كما يستخدم فنانو المكياج الأسيتون في إزالة لواصق الجلد أو البشرة الناتج عن وضع الشعر المستعار والشوارب عن طريق غمر العنصر في حمام أسيتون وبعد ذلك يتم إزالة بقايا الغراء أو المادة الصمغية بفرشاة قوية. كما يضيف بعض عشاق السيارات الأسيتون بحوالي نسبة جزء إلى (500)جزء للوقود وذلك بعد مطالبات لتحسين استهلاك الوقود وعمر المحرك.[21]
الأمان والسلامة
[عدل]قابلية الاشتعال
[عدل]الخطر الأكثر شيوعا المرتبط بالأسيتون يتمثل في قابليته الشديدة للاشتعال حيث أنه يشتعل تلقائيا عند درجة حرارة (465)درجة مئوية (869) درجة فهرنهايت.وفي درجات حرارة أعلى من نقطة وميض الأسيتون (-20) درجة مئوية (-4) درجة فهرنهايت، مخاليط هوائية في ما بين (2,5 %)، (12,8 %) من الأسيتون من حيث الحجم، يمكن أن تنفجر أو أن تسبب حريق وميضي ويمكن للأبخرة أن تتدفق على أسطح مصادر الاشتعال أو الاحتراق البعيدة وتمض مرة أخرى.التفريغ أو التصريف الثابت قد يشعل أيضا أبخرة الأسيتون.[22]
المعلومات الصحية
[عدل]تمّ دراسة الأسيتون على نطاق واسع ومن المسلم به عموما أنه يعدّ منخفض السمية الحادة والمزمنه وذلك إذا تم بلعه أو استنشاقه.وتسبب استنشاق تركيزات عالية (حوالي 9200جزء من المليون) في الهواء، تهيج في الحلق عند البشر وذلك لأقل من خمسة دقائق. ويسبب استنشاق تركيزات قدرها (1000جزء من المليون) تهيج في العين والحلق لمدة أقل من ساعة ومع ذلك استنشاق (500 جزء من المليون) من الأسيتون في الهواء لا يسبب أي أعراض من التهيج عند البشر حتى بعد مرور ساعتين من التعرض.لايعدّ الأسيتون حاليا مادة مسرطنه وهي مادة كيميائية مطفرة أو مصدر قلق للتأثيرات السمية العصبية المزمنة.[22]
ويمكن إيجاد الأسيتون كمكون لمجموعه متنوعه من المنتجات الاستهلاكية التي تتراوح من مستحضرات التجميل إلى الأغذية المصنعة والغير مصنعه وقد تم تصنيف الأسيتون كـ(GRAS)= (مُعترف به عموما أو مادة آمنة) وذلك عند تواجده في المشروبات والمخبوزات والحلويات ويتم حفظه بتركيزات تتراوح ما بين (5-8 ملجم/ لتر).بالإضافة إلى ذلك، وجدت دراسة مشتركة بين الولايات المتحدة وأوروبا أن الأخطار الصحية للأسيتون تعتبر طفيفة. (بحاجة لمصدر)
السمّية
[عدل]يعتقد أن الأسيتون له سمية طفيفة عند الاستعمال العادي ولا يوجد هناك أدلة قوية على آثار صحية مزمنه إذا ما اتبعت الاحتياطات الأساسية.[23]
في حالة وجود تركيزات عالية جدا من البخار يسبب الأسيتون حدوث تهيج ومثل مذيبات أخرى كثيرة يمكنه أن يؤثر ويثبط من عمل الجهاز العصبي المركزي. ويعدّ أو يمثل أيضا مصدر إزعاج شديد عند ملامسته للعينين ويسبب مخاطر محتملة للتطلع أو التنفس الرئوي.وفي حالة واحدة موثقة، ابتلاع كمية كبيرة من الأسيتون أدت إلى تسمم شامل على الرغم من أن المريض تعافى تماما في نهاية المطاف.[24] وتُقدّر بعض المصادر (LD50)لابتلاع الإنسان عند (1,159) جم/كجم، استنشاق (LD50) بواسطة الفئران أعطى على أنه (44)جم/م3 لأكثر من أربعة ساعات.[25] وقد تبين أن للأسيتون أثار مضادة للصرع في النماذج الحيوانية المصابة بالصرع وذلك في غياب السمية، عندما يتم يتناوله في تركيزات تقاس بالميللي مولار .[26] ولقد تم افتراض أن الحمية الكيتونية المرتفعة الدهون ومنخفضة الكربوهيدرات قد تُستخدم عملياً لمكافحة مقاومة الأدوية للصرع عند الأطفال حيث تعمل على رفع نسبة الأسيتون في المخ.[26]
- شطب وكالة حماية البيئة (1995). أزالة وكالة حماية البيئة الأسيتون من قائمة «المواد الكيميائية السامة» المحفوظة أو المدرجة تحت القسم (313) من التخطيط للطوارئ وحق المجتمع المحلي في قانون "EPCRA".وبإتخاذ هذا القرار قامت وكالة حماية البيئة باستعراض واسع النطاق للبيانات المتاحة عن سمية الأسيتون ووجدت أن الأسيتون له سمية حادة فقط على المستويات المتجاوزة كثيرا للإطلاقات أو التعرضات المترتبة وكذلك وجد أن الأسيتون له سمية منخفضة في الدراسات المزمنة.
- السمية الوراثية. تم اختبار الأسيتون في أكثر من دستتين (24)فحص معملي وفي الجسم الحي.
وقد أشارت تلك الدراسات أن الأسيتون غير سام وراثياً.
- مسببات السرطان. خلصت وكالة حماية البيئة في عام (1995) إلى أنه لا يوجد هناك أية أدلة حاليا تشير إلى أن الأسيتون يمثل مصدر قلق للسرطنه (استعراض "EPCRA" وصف في القسم "3-3"). ولم يقد العلماء أي نص يرجح أن الأسيتون يسبب سمية مزمنه خلال اختبار السرطنه للأسيتون وذلك لأن الدراسات ما قبل المزمنه أثبتت فقط وجود استجابة سامه خفيفة جدا عند تواجد الأسيتون بجرعات عالية جدا في القوارض.
- السمية العصبية والسمية العصبية المتنامية. تم دراسة احتمالية تسبب السمية العصبية لكل من الأسيتون والأيزوبروبانول وهو ممهد التمثيل الغذائي للأسيتون على نطاق واسع وقد أوضحت هذه الدراسات أنه بالرغم من أن التعرض لجرعات عالية من الأسيتون قد يسبب آثار عابرة على الجهاز العصبي المركزي إلا أن الأسيتون يعدّ غير سام للأعصاب. وقد أجريت دراسة توجيهية مبدأية عن تسمم الأعصاب باستخدام الأيزوبروبانول ولم يتم العثور على أية آثار نمائية لتسمم الأعصاب حتى عند اختبار أعلى جرعة (SIAR) صفحة (1, 25، 31).
- بيئياً. عندما أعفت وكالة حماية البيئة الأسيتون من اللائحة كمركب عضوي متضاير في عام 1995 أقرت وكالة حماية البيئة أن هذا الإعفاء أو الاستثناء من شأنه أن «يساهم في تحقيق أهداف بيئية هامة وسيدعم جهود وكالة حماية البيئة في منع التلوث» (60fed.Reg.31,634) (16 يونيو عام 1995), ولاحظت وكالة حماية البيئة أن الإسيتون يمكن استخدامه «باعتباره بديلاً للمركبات العديدة المسرودة على أنها ملوثات هوائية خطيرة» في إطار الباب (112) من قانون (الهواء النظيف).
التأثيرات البيئية
[عدل]يتبخر الأسيتون بسرعة حتى من المياه والتربة وبمجرد تواجده في الغلاف الجوي يتم تكسيره بفعل الأشعة الفوق بنفسجية حيث تكون دورة نصف العمر الخاصة به (22) يوم. ويتلاشى الأسيتون ببطء في التربة والحيوانات أو في المجاري المائية حيث يتم استهلاكه في بعض الأحيان من قِبل الكائنات الحية الدقيقة، [27] ولكنه يُعتبر ملوث كبير للمياه الجوفية نتيجة لذوبانه العالي في الماء (LD50) للأسيتون في الأسماك (8,3) جرام/ لتر من الماء (أو حوالي 0,8%)على مدى 96 ساعه ودورة نصف العمر البيئية حوالي (1-10 أيام) وقد يُشكّل الأسيتون خطراً كبيراً على نضوب الأكسجين في الأنظمة المائية وذلك بسبب النشاط الميكروبي المستهلك له.[28]
بيروكسيد الأسيتون
[عدل]المقال الرئيسي : بيروكسيد الأسيتون
عندما يتاكسد الأسيتون فإنه يكون بيروكسيد الأسيتون كناتج ثانوي وهو مركب غير مستقر للغاية فقد يتشكل أو يتكون بطريق بالصدفة على سبيل المثال : عندما يتم صب مُخلفات بيروكسيد الهيدروجين على مُخلفات مذيب يحتوي على الأسيتون. كما أن بيروكسيد الأسيتون لديه أكثر من عشرة أضعاف حساسية النيتروجلسرين ضد الاحتكاك والصدمات. وبسبب عدم استقراره، فإنه نادراً ما يتم استخدامه، على الرغم من سهولة تحضيره الكيميائي.
طالع أيضاً
[عدل]المراجع
[عدل]- ^ فهرس ميرك, 15th Ed. (2013), p. 13, Acetone Monograph 65, O'Neil: الجمعية الملكية للكيمياء.(الاشتراك مطلوب) نسخة محفوظة 20 مارس 2020 على موقع واي باك مشين.
- ^ "Acetone". بوب كيم. USA: المركز الوطني لمعلومات التقانة الحيوية. مؤرشف من الأصل في 2014-10-15.
- ^ ا ب ج "Acetone". NIST Chemistry WebBook. USA: المعهد الوطني للمعايير والتقنية. مؤرشف من الأصل في 2018-09-17.
- ^ Klamt، Andreas (2005). COSMO-RS: From Quantum Chemistry to Fluid Phase Thermodynamics and Drug Design. Elsevier. ص. 92–94.
- ^ Ash، Michael؛ Ash، Irene (2004). Handbook of preservatives. Synapse Information Resources, Inc. ص. 369.
- ^ Myers، Richard L. (2007). The 100 Most Important Chemical Compounds: A Reference Guide. Greenwood. ص. 4–6.
- ^ ا ب "NIOSH Pocket Guide to Chemical Hazards #0260". المعهد الوطني للسلامة والصحة المهنية (NIOSH).
- ^ ا ب acetone نسخة محفوظة 21 يوليو 2017 على موقع واي باك مشين.
- ^ Acetone in Linstrom, P.J.; Mallard, W.G. (eds.) NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD. http://webbook.nist.gov (retrieved 2014-05-11)
- ^ Working with modern hydrocarbon and oxygenated solvents: a guide to flammability American Chemistry Council Solvents Industry Group, pg. 7, January 2008 نسخة محفوظة 01 يونيو 2009 على موقع واي باك مشين.
- ^ "Acetone". Immediately Dangerous to Life and Health. المعهد الوطني للسلامة والصحة المهنية (NIOSH).
- ^ عبد الخالق رمضان الشيخ (2004). القاموس البيطري: إنجليزي عربي بالصور والرسومات الإيضاحية والجداول (بالعربية والإنجليزية). القاهرة: مكتبة شهوان للطباعة. ص. 145. ISBN:978-977-6099-13-5. OCLC:4770441762. QID:Q125605472.
- ^ عبد الخالق رمضان الشيخ (2004). القاموس البيطري: إنجليزي عربي بالصور والرسومات الإيضاحية والجداول (بالعربية والإنجليزية). القاهرة: مكتبة شهوان للطباعة. ص. 6. ISBN:978-977-6099-13-5. OCLC:4770441762. QID:Q125605472.
- ^ معجم مصطلحات الكيمياء (بالعربية والإنجليزية والفرنسية) (ط. 1)، دمشق: مجمع اللغة العربية بدمشق، 2014، ص. 9، OCLC:931065783، QID:Q113378673
- ^ ا ب ج أ ب ج د Stylianos Sifniades, Alan B. Levy, “Acetone” in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.
- ^ ا ب ج أ ب ج Acetone, World Petrochemicals report, January 2010 نسخة محفوظة 14 أكتوبر 2011 على موقع واي باك مشين.
- ^ ا ب NALGENE Labware – Technical Data نسخة محفوظة 22 فبراير 2012 على موقع واي باك مشين.
- ^ History – Acetylene dissolved in acetone نسخة محفوظة 15 سبتمبر 2015 على موقع واي باك مشين.
- ^ Mine Safety and Health Administration (MSHA) – Safety Hazard Information – Special Hazards of Acetylene نسخة محفوظة 22 يناير 2016 على موقع واي باك مشين.
- ^ ا ب A. Lozano, B. Yip and R. K. Hanson (1992). "Acetone: a tracer for concentration measurements in gaseous flows by planar laser-induced fluorescence". Exp. Fluids [الإنجليزية] 13: 369–376.doi:10.1007/BF00223244. نسخة محفوظة 20 مارس 2020 على موقع واي باك مشين. [وصلة مكسورة]
- ^ Louis LaPonte (2007-02-13). "Acetone in Fuels (A Study of Dimethylketone or Propanone)". http://www.brightgreen.us/lubedev/smartgas/additive.htm. وصل لهذا المسار في 2007-06-06. نسخة محفوظة 02 أبريل 2018 على موقع واي باك مشين.
- ^ ا ب ^ أ ب Acetone MSDS نسخة محفوظة 11 أكتوبر 2017 على موقع واي باك مشين.
- ^ Basic Information on Acetone نسخة محفوظة 05 ديسمبر 2012 على موقع واي باك مشين.
- ^ Canadian Centre for Occupational Health and Safety."Health Effects of Acetone". http://ccohs.ca/oshanswers/chemicals/chem_profiles/acetone/health_ace.html. وصل لهذا المسار في 2008-10-21. نسخة محفوظة 27 أكتوبر 2000 على موقع واي باك مشين.
- ^ ^ Safety (MSDS) data for propanone نسخة محفوظة 21 أغسطس 2011 على موقع واي باك مشين.
- ^ ا ب أ ب Likhodii SS, Serbanescu I, Cortez MA, Murphy P, Snead OC 3rd, Burnham WM (2003). "Anticonvulsant properties of acetone, a brain ketone elevated by the ketogenic diet". Ann Neurol [الإنجليزية] 54 (2): 219–226.doi:10.1002/ana.10634. PMID12891674. نسخة محفوظة 13 يناير 2017 على موقع واي باك مشين.
- ^ Acetone, Agency for Toxic Substances and Disease Registry ToxFAQs, 1995 نسخة محفوظة 07 يوليو 2017 على موقع واي باك مشين.
- ^ Safety Data Sheet Acetone نسخة محفوظة 05 مارس 2016 على موقع واي باك مشين. [وصلة مكسورة]





